
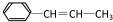 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 可以发生加成、取代、氧化反应 | |
| B. | 能使溴水褪色,但不能使酸性高锰酸钾褪色 | |
| C. | 能发生加聚反应,其生成物可用 来表示 来表示 | |
| D. | 易溶于水,也易溶于有机溶剂 |
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有少量硫的酒精溶液,加入大量水后形成乳白色液体,用滤纸过滤不能分离出硫 | |
| B. | 原硅酸溶液中加入硫酸铵饱和溶液,结果产生沉淀 | |
| C. | 硫酸铜溶液中加入硫化钠溶液产生黑色沉淀 | |
| D. | 用水稀释牛奶,用一束强光照射,从侧面观察,可以看到一条清晰的光路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 第一组 | A-268.8 | B-249.5 | C-185.8 | D-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | Br2 58.7 | I2 184.0 |
| 第三组 | HF 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | H2Se 42.0 | H2Te-1.8 |
| A. | 第一组和第二组物质中一定含有共价键 | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr>H2Se | |
| C. | 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操 作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中不再产生气泡;试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液. | 试管A、B中均未明显见到有气泡产生 |
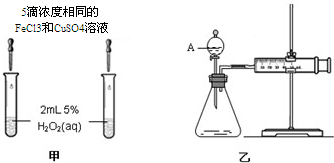
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①④ | C. | ①②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g苯中含有C-C单键数目为0.3NA | |
| B. | 标准状况下,2.24L的CHCl3中含有的C-H键数为0.1NA | |
| C. | 1.4g C2H4和C3H8的混合物中含碳原子数为0.1 NA | |
| D. | 13克溶有乙炔的苯乙烯,其所含的电子数目为7 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰升华 | B. | 氯化钠和冰的熔化 | ||
| C. | 二氧化硅和氧化钠熔化 | D. | 食盐和蔗糖熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅦA元素的氢化物中氟化氢的沸点最高 | |
| B. | 第三周期元素形成的简单离子的半径随原子序数的增大依次增大 | |
| C. | I2易溶于CCl4可以用相似相溶原理解释 | |
| D. | CH2=CH2分子中共有5个σ键和1个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能 (kJ•mol-1) | 386 | 167 | 498 | 946 | 460 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com