
X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大,下列说法正确的是( )
A.M与X形成的化合物对应的水化物一定是强酸
B.Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同
C.X、Y的简单离子半径:r(X2﹣)>r(Y+)
D.M的气态氢化物比X的气态氢化物稳定
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷(解析版) 题型:选择题
X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:
X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于 ( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于 ( )
A.33% B.67% C.50% D.40%
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:实验题
某化学兴趣小组进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。
经过小组讨论,他们设计了如下装置进行实验(夹持装置未画出):烧瓶A中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制取N2),干燥管B、G中均装有碱石灰,试管D、F、I中盛有澄清石灰水。

(1)连接好装置后,加入药品前应该进行的实验操作是_____________(填操作名称)。
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是___________________。
(3)试管E中的试剂为:________________。
(4)装置F的作用:______ ___。
Ⅰ.定性研究
(5)试管D中出现浑浊,证明产物中有____________存在;证明分解产物中存在CO的现象是_________________;要证明分解时产生的另一种气态产物的存在应该如何改进装置_____________;装置C反应后的固体残余物(经测无Fe),在煮沸的稀硫酸中完全溶解,取反应液加入KSCN溶液无血红色,证明固体产物为____________。
Ⅱ.定量分析(假定每一步反应进行完全)
(6)取7.2 g样品进行上述实验,测得硬质玻璃管C中残余固体2.88 g,硬质玻璃管H中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省十校共同体高三上学期12月联考化学试卷(解析版) 题型:选择题
可逆反应X(g)+Y(g) 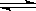 2Z(g) △H<0达到平衡时,下列说法正确的是
2Z(g) △H<0达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第二次模拟化学试卷(解析版) 题型:选择题
有机物A的分子式为C5H10O2,其在氢氧化钠溶液中加热水解得B、C两种物质,已知B能与盐酸反应生成E,E能发生银镜反应,而C不能发生银镜反应。则A可能的结构有
A. 1种 B. 2种 C. 3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上第二次阶段测化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.以Al作阳极,Fe作阴极,可以实现铁上镀铝
B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解
C.向纯水中加入盐酸或降温,都能使水的电离平衡逆向移动,水的离子积减小
D.3C(s)+ CaO(s)=CaC2(s)+ CO(g)在常温下不能自发进行,说明该反应的△H>0
查看答案和解析>>
科目:高中化学 来源:2016届江苏省南京市六校高三上学期12月联考化学试卷(解析版) 题型:选择题
下列有关物质的性质和该性质的应用均正确的是
A.炭具有强还原性,高温下能将二氧化硅还原为硅
B.Na的金属性比Mg强,可用Na与MgCl2溶液反应制取金属Mg
C.光照时乙烷和氯气能发生取代反应,工业上常用该反应生产氯乙烷
D.二氧化锰具有强氧化性,能将双氧水氧化为氧气
查看答案和解析>>
科目:高中化学 来源:2016届上海市十三校高三上学期第一次联考化学试卷(解析版) 题型:选择题
已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判断溶液呈中性的依据是
A.a = b
B.混合溶液中,c(H+) + c(B+) = c(OH-) + c(A-)
C.混合溶液中,c(H+) = 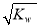
D.混合溶液的pH = 7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中考试化学试卷(解析版) 题型:填空题
过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。

(1)据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如图所示。该电池放电时正极的电极反应式为_________________________;MnO2除了作正极材料外,还可能对电极反应具有_________________作用。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。已知:
N2H4(l)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
H2O2(l)===H2O(l)+O2(g),ΔH=-98 kJ·mol-1
H2O(l)===H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___________________。
(3)O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。

①图中阴极为___________(填“A”或“B”)。
②若C处不通入O2,A极的电极反应式为_________________。
③若C处通入O2 ,则A极的电极反应式为_________________。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g) NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________。
NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________。

a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com