
��8�֣�
��1����֪��N2��g��+O2��g��=2NO��g��; ��H=+180��5 kJ��mol-1
4NH3��g��+5O2��g��=4NO��g��+6H2O��g������H=-905 kJ��mol-1
2H2��g��ʮO2��g��=2HO��g������H=--483��6 kJ��mol-1
��N2��g��+3H2��g�� 2NH3��g���ġ�H=
��
2NH3��g���ġ�H=
��
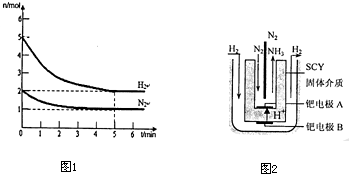
��2����һ�������£���2mol N2��5mol H2�����һ��10 L���ܱ������У���Ӧ�����ͼ1��ʾ��
����5min�ڵ�ƽ����Ӧ����v��NH3�� ��
�ڴﵽƽ��ʱNH3���������Ϊ ��

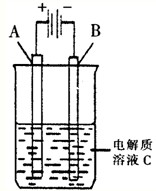
��3����������ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ�������������������ϵĽ����ٶ�Ʒ��Ĥ���缫��ʵ���˸�ת���ʵĵ�ⷨ�ϳɰ���װ����ͼ2�����ٵ缫A�Ϸ����ĵ缫��Ӧʽ�� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �� |
| Cu2O |
| ʱ��/min | 20 | 40 | 60 | 80 |
| n��O2��/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺| t/s | 0 | 500 | 1000 |
| c��N2O5��/mol?L-1 | 5.00 | 3.52 | 2.48 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �£�N2H4���ֳ���������һ�ֿ�ȼ��Һ�壬��ȼ���Ƚϴ���ȼ�ղ���Ի�������Ⱦ���ʿ����������ȼ�ϣ�
�£�N2H4���ֳ���������һ�ֿ�ȼ��Һ�壬��ȼ���Ƚϴ���ȼ�ղ���Ի�������Ⱦ���ʿ����������ȼ�ϣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO������10-4mol?L-1�� | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c��NO������10-3mol?L-1�� | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com