
| 阳离子 | Ba2+、H+、Na+、Mg2+ |
| 阴离子 | Cl-、SO42-、CO32-、OH- |
| 实验序号 | 实验内容 | 实验结论 |
| 1 | 用pH试纸测得A、C两溶液呈碱性,B、D两溶液呈酸性 | |
| 2 | A溶液与B溶液混合时,有无色气泡产生 | 化合物A为 Na2CO3 Na2CO3 (填化学式)B溶液中肯定大量含有H+ H+ (填离子符号); |
| 3 | C与D两溶液混合时,有白色沉淀生成,过滤,向沉淀中滴加过量盐酸,沉淀部分溶解 | 化合物B为 HCl HCl ,化合物D为MgSO4 MgSO4 (填化学式). |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
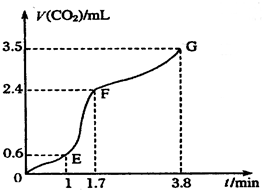 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| m | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
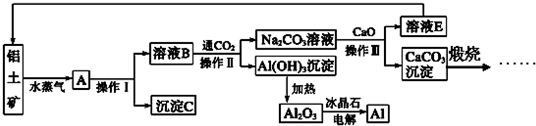
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com