
 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )| A. | b电极是负极 | |
| B. | 装置中的离子交换膜是阳离子交换膜 | |
| C. | 阳极电极反应:4OH--4e-═2H2O+O2↑ | |
| D. | a极区的KI最终转变为KIO3 |
分析 根据图知,a是阳极,b是阴极,电解时,阳极上碘离子失电子发生氧化反应,阴极上得电子发生还原反应,据此分析解答.
解答 解:A.b是阴极,阴极连接外电源的负极,故A错误;
B.电解池中阴离子移向阳极,即OH-从b极区通过离子交换膜c进入a极区,则离子交换膜应为阴离子交换膜,故B错误;
C.在电解池的阳极先是阴离子碘离子发生失电子的氧化反应,然后才是氢氧根离子的失电子反应,故C错误;
D.在电解池的阳极a极,是碘离子发生失电子的氧化反应,最终生成碘酸根离子,反应式:I--6e-+6OH-═IO3-+3H2O,则a极区的KI最终转变为KIO3,故D正确.
故选D.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,难点是电极反应式的书写,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 ;(提示:反应过程中无碘单质生成;Cu 做催化剂)
;(提示:反应过程中无碘单质生成;Cu 做催化剂) ;
; )为主要有机原料(无机原料任选),写出合成己二酸的合成线路:
)为主要有机原料(无机原料任选),写出合成己二酸的合成线路: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溴和苯分别受热变为气体 | B. | 干冰和氣化铵分别受热变为气体 | ||
| C. | 氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
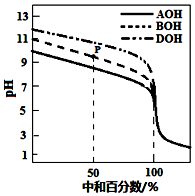 室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol•L-1的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是( )
室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol•L-1的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是( )| A. | 滴定时,随着盐酸溶液的滴入,水电离出的c(H+)始终增大 | |
| B. | 滴定至P点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+) | |
| C. | pH=7时,三种溶液中c(Cl-) 相等 | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH${\;}_{4}^{-}$和 NH${\;}_{4}^{+}$是等电子体,键角均为 60° | |
| B. | NO${\;}_{3}^{-}$和 CO${\;}_{3}^{2-}$是等电子体,都是平面三角形结构 | |
| C. | H3O和 PCl3是等电子体,均为三角锥形结构 | |
| D. | B3N3H6 和苯是等电子体,B3N3 H6 分子中也存在“肩并肩”式重叠的轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| B. | 木材、纺织品浸过水玻璃后,具有防腐性能且不易燃烧 | |
| C. | 二氧化硅是一种半导体材料,常用于制造光导纤维 | |
| D. | 铁红颜料与某些油料混合,可以制成防锈油漆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com