
按要求填空
(一)、X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的一种单质具有特殊臭味,Z与X原子最处层电子数相同。回答下列问题:
(1)由上述元素组成的化合物中,既含有极性共价键又含有离子键的化合物的电子式 ;
(2)X和Y组成的化合物中,有一种既含有极性共价键又含有非极性共价键。此化合物可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为
(二)、在一定条件下,RO3nˉ 和Iˉ 发生反应,离子方程式为: RO3nˉ+6Iˉ+6H+==Rˉ+3I2+3H2O
RO3nˉ-中R元素的化合价为 ,R元素的原子最外层电子有 个。
(三)、Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1︰16,则x值是
(四)、已知M2On2ˉ可与R2ˉ作用,R2ˉ被氧化为R的单质,M2On2ˉ的还原产物中,M为+3价,又知c(M2On2ˉ)=0.3mol/L的溶液100mL可与c(R2ˉ)=0.6mol/L的溶液150mL恰好完全反应,则n值为 。
(一)(1)NaOH (2)H2O2+CN-+OH-=CO32-+NH3
(二)+5 7 (三)5 (四)7
【解析】
试题分析:
(一)(1)NaOH满足条件 (2)略
(二)根据离子反应电核守恒思想,可以推断反应前的离子所带电核总数为-1(因为反应后离子所带电核总数为-1)。又因为I-与H+离子所带电核总数为之和为0,因此RO3 n-所带电核数为-1,因此n=1。于是可以推断RO3 n-中R的化合价为+5;(2)由于R-只带一个单位负电核,说明R原子只能得到一个电子。因此R最外层电子数为7
(三)得失电子守恒 ,化合价升降相等
1Na2Sx 中S的化合价-2/x价
1Na2Sx---------------Na2SO4 化合价升高x×(6+2/x),
16NaClO-------------NaCl 化合价降低16×2=32
升降相等 x×(6+2/x)=32 x=5
(四)100ml 0.3 mol·L-1M2On2-中M为n-1价 被还原为2M 3+
0.6mol·L-1150mLR2-被氧化为R单质根据得失电子守恒: 0.1*0.3*2(n-1-3)=0.15*0.6*[0-(-2)]
解得:n=7
考点:考查了氧化还原反应、元素化合物的推导等知识。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 浓H2SO4 |
| 170℃ |
| 浓H2SO4 |
| 170℃ |
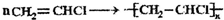
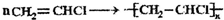
查看答案和解析>>
科目:高中化学 来源: 题型:
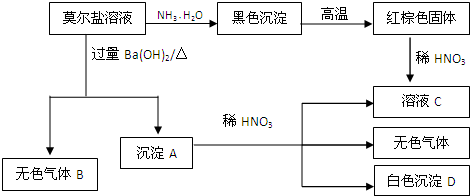
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com