
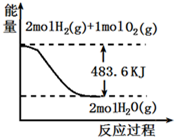
| A、表示1mol H2(g)完全燃烧生成水蒸气吸收241.8kJ热量 | ||
B、表示的热化学方程式为:H2(g)+
| ||
| C、表示2mol H2(g)所具有的能量一定比2mol气态水所具有的能量多483.6kJ | ||
| D、H2O(g)的能量低于H2(g)和O2(g)的能量之和 |
| 1 |
| 2 |
| 1 |
| 2 |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
 某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0g铝片放入圆底烧瓶中,然后通过分液漏斗加入500mL 0.5mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示),请你帮助该小组同学回答下列问题:
某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0g铝片放入圆底烧瓶中,然后通过分液漏斗加入500mL 0.5mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示),请你帮助该小组同学回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 光 |
| ||
| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(17分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式为:
CH4(g)+2O?2(g)=CO2(g)+2H2O(g)△H=-802.3kJ?mol-1
H2O(l)=H2O(g) △H=+44kJ?mol-1
则356g“可燃冰”(分子式为CH4?9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为 。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:正极反应式:
O2+2CO2+4e-=2CO2-3,负极反应式 。
(3)已知一氧化碳与水蒸气的反应为:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol/L)变化
时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | c1 |
6 | 0.096 | 0.266 | 0.104 | c2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 。T℃时该化学反应的平衡常数是 。
②已知420℃时,该化学反应的平衡常数为9,如果反应开始时,CO(g)和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为 。
③397℃时,该反应的化学平衡常数为12,请判断该反应的△H 0(填“>、=、<”)。
(4)燃料电池中产生的CO2气体可以用碱液吸水得到Na2CO3和NaHCO3。常温下向20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。根据图象回答下列问题:

①在同一溶液中,H2CO3、HCO-3、CO2-3(填:“能”或“不能”) 大量共存。②当pH=7时溶液中含碳元素的主要微粒为 ,此时溶液中c(HCO-3) c(Na+)(填“>、=、<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com