
| A. | 18 g | B. | 24 g | C. | 30 g | D. | 36 g |
分析 硝酸得电子变成氮的氧化物,铁在反应中失电子变成铁离子或亚铁离子,加碱后生成氢氧化物,对沉淀加热生成氧化铁沉淀,在反应中铁失电子数和硝酸得电子数相等,以此进行计算.
解答 解:硝酸得电子变成氮的氧化物,铁在反应中失电子变成铁离子或亚铁离子,加碱后生成氢氧化物,对沉淀加热生成氧化铁沉淀,在反应中铁失电子数和硝酸得电子数相等.根据HNO3$\stackrel{+3e-}{→}$NO,HNO3$\stackrel{+e-}{→}$NO2,生成0.3molNO2转移的电子为:0.3mol×1=0.3mol,生成0.2molNO转移的电子为:0.2mol×3=0.6mol,共转移0.9mol电子,
若反应中Fe失去3个电子变成铁离子Fe$\stackrel{3e-}{→}$Fe3+$\stackrel{3OH-}{→}$Fe(OH)3$\stackrel{△}{→}$ $\frac{1}{2}$Fe2O3,
3mol 80g
0.9mol 24g
若反应中Fe失去2个电子变成亚铁离子Fe$\stackrel{2e-}{→}$Fe2+$\stackrel{2OH-}{→}$Fe(OH)2$\stackrel{H_{2}O+H_{2}O}{→}$Fe(OH)3$\stackrel{△}{→}$$\frac{1}{2}$Fe2O3,
2mol 80g
0.9mol 36g
若铁既变成铁离子由变成亚铁离子,则得到的沉淀介于24g-36g之间,则得到固体质量不可能为18g,
故选A.
点评 本题考查氧化还原反应的计算,题目难度中等,注意铁既可失去3个电子又可失去2个电子,注意掌握讨论法、守恒思想在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:推断题

 +(2n-1)H2O.
+(2n-1)H2O.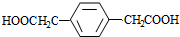 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 | B. | Na2CO3 | C. | Ca(OH)2 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用木材作燃料 | B. | 用柴油替代汽油 | C. | 把煤变成煤气 | D. | 开发风能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据反应3NO2+H2O═2HNO3+NO可知,NO2是HNO3的酸酐 | |
| B. | 据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知浓HNO3的氧化性不如稀HNO3强 | |
| C. | 据反应2NO2(g)?N2O4(g)△<0可知要制得较纯净的NO2,需高温、低压环境 | |
| D. | NO2、Br2(g)同为红棕色气体,可用湿润的淀粉-KI试纸鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷的密度比水大,且难溶于水 | B. | 己烷在光照时能发生取代反应 | ||
| C. | 己烷在光照时能发生加成反应 | D. | 己烷不易燃烧,可作为灭火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的碱性减弱,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗0.1molO2则阳极理论上生成0.2molCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com