
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
 ②有关有机物的沸点:
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__________。
(2)球形干燥管C的作用是______________________。若反应前向D中加入几
(3)滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)________;反应结束后D中的现象是__________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________。
 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用。甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如下:
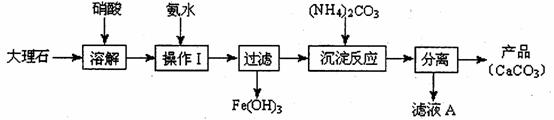
①溶解大理石时,用硝酸而不用硫酸的原因是 。
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、 、 。
③“滤液A”中除H+离子外,还含有的阳离子是 ;检验该阳离子的实验方法是:取少量滤液A与 在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可。
(2)乙组对某硫酸钙晶体(xCaS04·yH20)加热分解的有关反应进行探究。他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如下图所示。又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:
 2CasO4 2CaO+2S02↑+O2↑。
2CasO4 2CaO+2S02↑+O2↑。
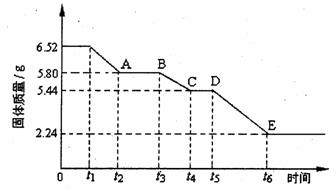
①加热时,该晶体开始发生化学变化的时间是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体的化学式为 。
③tl~t2时间段固体发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用正确的是( )
A. 硫原子的原子结构示意图:
B.NH4Cl的电子式: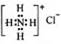
C.原子核内有10个中子的氧原子:
D.纯碱的化学式为NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
要证明氯乙烷中氯元素的存在可进行如下操作,其中顺序正确的是( )
①加入AgNO3溶液②加入NaOH溶液③加热④加入蒸馏水⑤加入HNO3酸化
A.②③⑤① B.④③⑤① C.④①⑤ D.②③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数为NA,下列说法正确的是
A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA
B.1mol NH3含有的电子数10NA
C.常温常压下,22.4 L的氧气含氧原子数为2NA
D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
聚碳酸酯无色透明,具有优异的抗冲击性,能用于制造宇航员的面罩、智能手机机身外壳等。双酚化合物是合成聚碳酸酯的单体之一,某种双酚化合物G的合成路线如下:
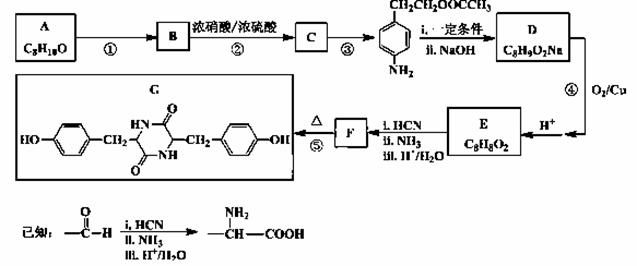
(1)G中所含的官能团除苯环外,还有________________。
(2)写出反应类型。反应 ① ___________;反应 ③ ____________。
(3)写出结构简式。A ______________;F ______________。
(4)写出反应 ④ 的化学方程式_______________________________________。
(5)C有多种同分异构体,写出同时满足下列条件的同分异构体的结构简式_____________。
(I)属于α-氨基酸,且苯环上有三个互为间位的取代基
(II)与FeCl3溶液作用无显色现象
(III)1 mol该同分异构体与足量NaOH溶液反应时,最多能消耗3 mol NaOH
(6)最常见的聚碳酸酯是用双酚A(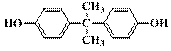 )与光气(
)与光气(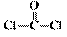 )聚合得到,请写出该聚碳酸酯的结构简式______________________________。
)聚合得到,请写出该聚碳酸酯的结构简式______________________________。
已知:
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.—OH与OH— 含有的电子数相同 B. 1 mol C3H8分子中含有的共价键数目为11 NA
C.1mol碳正离子CH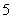 所含的电子数为10NA D.标准状况下,22.4 L CCl4中含有NA个碳原子
所含的电子数为10NA D.标准状况下,22.4 L CCl4中含有NA个碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验。
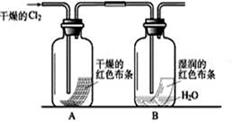
①写出Cl2与水反应的离子方程式 。
②通入Cl2后,从集气瓶A、B的现象可得出的结论是 ;从化学实验的安全环保角度考虑,你认为还应增加的装置是 。
(2)碘是人体中不可缺少的微量元素,食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。
①食盐中加入碘化钾的碘损失率高的原因是 ;
②萃取碘水中的碘时,一般选用的试剂是(填字母) ;
A.酒精 B.四氯化碳 C.醋酸 D.硝酸银溶液
③可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应的化学方程式为:
5KI+KIO3 + 6HCl =6KCl + 3I2 + 3H2O,反应的现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com