
分析 根据n=$\frac{N}{{N}_{A}}$计算氨气物质的量,再根据m=nM计算氨气的质量,氢原子物质的量为氨气的3倍,结合氢原子数目相等计算甲烷物质的量,再根据m=nM计算甲烷质量.
解答 解:6.02×1023个NH3分子的物质的量为$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,则氨气的质量为1mol×17g/mol=17g;与之含有相同氢原子数目的甲烷为$\frac{1mol×3}{4}$=0.75mol,则甲烷的质量为0.75mol×16g/mol=12g,
故答案为:17;12.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| P-P | P-O | P=O | O=O | |
| 键能 (kJ/mol) | a | b | c | d |
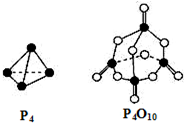
| A. | (4c+12b-6a-5d)kJ•mol-1 | B. | (6a+5d-4c-12b)kJ•mol-1 | ||
| C. | (4c+12b-4a-5d)kJ•mol-1 | D. | (4a+5d-4c-12b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应时,1molNa2O2转移1mol电子 | |
| B. | 78gNa2O2含有阴、阳离子总数是4NA | |
| C. | 1mo1•L-1的AlC13溶液中,C1-离子的数目为3NA | |
| D. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Cl- | C. | Mg2+ | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ•mol-1 | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com