
【题目】关于![]() 溶液,下列判断不正确的是 ( )
溶液,下列判断不正确的是 ( )
A. 粒子种类与![]() 溶液相同
溶液相同
B. 升高温度,![]() 增大
增大
C. 加入![]() 溶液,
溶液,![]() 减小
减小
D. ![]()
【答案】B
【解析】
从溶质的溶解直至水的电离,可知溶液中粒子种类;根据外因对化学平衡的影响分析浓度变化;由溶液的电中性原理可写电荷守恒关系。
A项:溶液中Na2CO3完全电离Na2CO3=2Na++CO32-,CO32-分两步水解CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH- ,水的电离H2O
H2CO3+OH- ,水的电离H2O![]() H++OH- 。同理可写出
H++OH- 。同理可写出![]() 溶液的各种过程,两溶液中粒子种类相同,A项正确;
溶液的各种过程,两溶液中粒子种类相同,A项正确;
B项:CO32-水解过程吸热,升高温度使水解平衡右移,![]() 减小,B项错误;
减小,B项错误;
C项:加入![]() 溶液,Ca2+与CO32-结合生成难溶于水的CaCO3沉淀,使
溶液,Ca2+与CO32-结合生成难溶于水的CaCO3沉淀,使![]() 减小,C项正确;
减小,C项正确;
D项:水溶液都是电中性的,符合电荷守恒![]() ,D项正确。
,D项正确。
本题选B。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
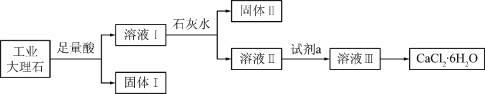
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下为中学化学中常见的几种物质:①NaOH溶液②铜丝③蔗糖晶体④无水乙醇⑤稀硫酸⑥液氨⑦氨水⑧SO2 ⑨硫酸钡晶体⑩熔融 NaC1,上述状态下可导电的________;上述状态下的电解质不能导电是__________________
(2)写出⑤和⑦发生反应的离子方程式___________________.
(3)在aLAl2(SO4)3和(NH4)2SO4的混合溶液中加入bmol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量NaOH 并加热可得到c molNH3,则原溶液中 A13+的物质的量浓度为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子排布图为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能 |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态![]() 再失去一个电子比气态
再失去一个电子比气态![]() 再失去一个电子难,其原因是___________________________。
再失去一个电子难,其原因是___________________________。
(4)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合“18电子规则”。如Cr可以与CO形成![]() 分子:价电子总数
分子:价电子总数![]() 的价电子数
的价电子数![]() 提供电子数
提供电子数![]() .Fe原子也能与CO形成配合物,其化学式为________.
.Fe原子也能与CO形成配合物,其化学式为________.
(5)已知Fe单质有如图所示的两种常见堆积方式:


其中属于体心立方密堆积的是______![]() 填“a”或“b”
填“a”或“b”![]() ;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
(6)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图装置研究气体X的性质,气体X的主要成分是Cl2,其中含有少量水蒸气。请回答下列问题:

(1)分别描述B、C装置中的现象____;结合化学方程式及物质性质说明B、C装置中现象不同的原因____。
(2)Cl2是有毒气体,为了防止多余Cl2污染空气,可以在D处用如图装置进行尾气处理,用化学方程式表示该原理____。气体应该由____(填“a”或“b”)管通入。若要吸收224mLCl2(标况下),至少需要1mol/L的上述溶液____mL。
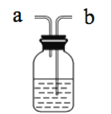
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为1L的密闭容器中,0.3molX和0.2molY进行反应:2X(g)+Y(s) ![]() Z(g),经10s达到平衡,生成0.1molZ。下列说法正确的是( )
Z(g),经10s达到平衡,生成0.1molZ。下列说法正确的是( )
A. 若增加Y的物质的量,则V正大于V逆平衡正向移动
B. 以Y浓度变化表示的反应速率为0.01mol·L-1·s-1
C. 该反应的平衡常数为10
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A元素的一种原子没有中子;B元素的原子得1个电子后形成的离子与氩原子电子数相同;C元素的原子第三层电子数比第二层少2个;D元素的原子与A原子构成的分子A2D有10个电子。则A的元素符号为_____ ;B的离子结构示意图为_________________;C的原子结构示意图为_____________;D的元素名称为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干离子组成,取该溶液进行如下实验:

(1)白色沉淀甲是___;
(2)试写出实验过程中生成气体A、B的离子方程式___;
(3)通过上述实验,可确定X溶液中一定存在的阴离子是___;尚未确定是否存在的离子是___;
(4)若要检验溶液中是否含有CO32-离子,其方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com