【答案】
分析:A、B、C、D、E均为短周期元素,且原子序数逐渐增大.A、D最外层电子数相等,则为同族元素,且A、D能形成离子化合物,该族含有金属与非金属,为短周期元素,故为第ⅠA族,结合A、D原子序数可知,A为氢元素,D为钠元素;A
+与 C
2-的核外电子数之和等于D
+离子的核外电子数,则C的质子数为10-2=8,故C为氧元素;A与B的质子数之和等于C的质子数,则B的质子数为8-1=7,故B为氮元素;B 原子与 D
+离子的核外电子数之和等于 E 原子的核外电子数,则E的核外电子数为7+10=17,故E为氯元素.
(1)B为N元素,E为氯元素.根据核外电子排布书写E原子结构示意图,根据稳定结构书写HClO电子式;
(2)过氧化钠具有强氧化性,将硫离子氧化为S单质,同时生成氢氧化钠;
(3)水溶液呈酸性的化合物,为酸或强酸弱碱盐,其中甲物质促进水的电离,甲为盐,则甲为NH
4NO
3,物质乙抑制水的电离,乙为酸,则乙为HNO
3.NH
4NO
3溶液中氢离子为水电离氢离子,根据pH值计算氢离子浓度,硝酸中水电离的氢离子浓度等于溶液中氢氧根离子浓度,利用Kw计算溶液中氢氧根离子浓度;
(4)常温下,pH=11的丙溶液中氢氧根离子浓度为10
-3mol/L,pH=3的丁溶液中氢离子浓度为10
-3mol/L,氨水是弱电解质,电离程度不大,等体积混合后溶液中氨水有剩余,剩余氨水浓度远大于氯化铵浓度;
(5)H
2与O
2构成燃烧电池,电解质溶液为KOH溶液,负极发生氧化反应,氢气在负极放电,在碱性条件下生成水,据此书写电极反应式.
解答:解:A、B、C、D、E均为短周期元素,且原子序数逐渐增大.A、D最外层电子数相等,则为同族元素,且A、D能形成离子化合物,该族含有金属与非金属,为短周期元素,故为第ⅠA族,结合A、D原子序数可知,A为氢元素,D为钠元素;A
+与 C
2-的核外电子数之和等于D
+离子的核外电子数,则C的质子数为10-2=8,故C为氧元素;A与B的质子数之和等于C的质子数,则B的质子数为8-1=7,故B为氮元素;B 原子与 D
+离子的核外电子数之和等于 E 原子的核外电子数,则E的核外电子数为7+10=17,故E为氯元素.
故A为氢元素,B为氮元素;C为氧元素;D为钠元素;E为氯元素.
(1)由上述分析可知,B为N元素;E为氯元素,原子核外有17个电子,有3个电子层,最外层有7个电子,原子结构示意图为

;由A、C、E三种元素组成的化合物具有漂白性,该化合物为HClO,分子中氧原子分别通过1对共用电子对与氢原子、氯原子连接,其电子式为
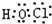
,
故答案为:N;

;
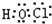
;
(2)将少量的Na
2O
2投入到Na
2S溶液中,过氧化钠具有强氧化性,将硫离子氧化为S单质,产生浑浊现象,同时生成氢氧化钠,则反应的离子方程式为 2H
2O+S
2-+Na
2O
2═4OH
-+S↓+2Na
+,
故答案为:2H
2O+S
2-+Na
2O
2═4OH
-+S↓+2Na
+;
(3)A为氢元素,B为氮元素;C为氧元素;A、B、C三种元素可组成多种化合物,水溶液呈酸性的化合物,为酸或强酸弱碱盐,其中甲物质促进水的电离,甲为盐,则甲为NH
4NO
3,物质乙抑制水的电离,乙为酸,则乙为HNO
3;室温下,若两溶液的pH都为4,NH
4NO
3溶液中氢离子为水电离氢离子,浓度为10
-4mol/L,硝酸中水电离的氢离子浓度等于溶液中氢氧根离子浓度,浓度为

=10
-10mol/L,则两溶液中水电离的氢离子浓度比为甲:乙=10
-4mol/L:10
-10mol/L=10
6,
故答案为:NH
4NO
3;HNO
3;10
6;
(4)A与B化合形成10电子化合物丙为NH
3,A与E化合形成18电子化合物丁为HCl,常温下,pH=11的丙溶液中氢氧根离子浓度为10
-3mol/L,pH=3的丁溶液中氢离子浓度为10
-3mol/L,氨水是弱电解质,电离程度不大,等体积混合后溶液中氨水有剩余,为氯化铵与氨水混合液,剩余氨水浓度远大于氯化铵浓度,一水合氨的电离程度大于铵根离子的水解程度C(NH
4+)>C(Cl
-),C(OH
-)>C(H
+),所以溶液的pH>7,溶液中离子浓度由大到小的顺序为C(NH
4+)>C(Cl
-)>C(OH
-)>C(H
+),
故答案为:;C(NH
4+)>C(Cl
-)>C(OH
-)>C(H
+);
(5)H
2与O
2构成燃烧电池,若电解质溶液为KOH溶液,负极发生氧化反应,氢气在负极放电,在碱性条件下生成水,该电池的负极反应为 H
2+2e
-+2OH
-=2H
2O,
故答案为:H
2+2e
-+2OH
-=2H
2O.
点评:本题以元素推断为载体,考查结构与位置关系、电子式等常用化学用语、离子方程式、盐类水解、原电池等,难度中等,关键是元素推断,突破口为A、D两元素推断,该知识对中学比较陌生,一般较少涉及金属氢化物.注意知识的积累与知识的综合运用.

 ;由A、C、E三种元素组成的化合物具有漂白性,该化合物为HClO,分子中氧原子分别通过1对共用电子对与氢原子、氯原子连接,其电子式为
;由A、C、E三种元素组成的化合物具有漂白性,该化合物为HClO,分子中氧原子分别通过1对共用电子对与氢原子、氯原子连接,其电子式为 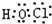 ,
, ;
; ;
; =10-10mol/L,则两溶液中水电离的氢离子浓度比为甲:乙=10-4mol/L:10-10mol/L=106,
=10-10mol/L,则两溶液中水电离的氢离子浓度比为甲:乙=10-4mol/L:10-10mol/L=106,






 写出四者之一即可
写出四者之一即可 写出四者之一即可
写出四者之一即可