

分析 以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应,水浸过滤分离,滤液为Na2CrO4、Na2SiO3、NaAlO2的溶液,过滤得到滤渣为氧化铁,调节溶液pH是硅酸根、偏铝酸根转化为硅酸、氢氧化铝沉淀,再过滤除去,得到Na2CrO4溶液,滤液中加入硫酸酸化生成重铬酸钠溶液,再经过加热浓缩、冷却结晶、过滤等操作得到重铬酸钠.
(1)增大接触面积,提高水浸效率;SiO32-、AlO2-易与酸反应生成H2SiO3、Al(OH)3沉淀;
(2)铬矿石中加入碳酸钠和氧气高温灼烧发生反应生成铬酸钠、二氧化碳;硫酸酸化使Na2CrO4转化为Na2Cr2O7;
(3)Al3+沉淀完全的浓度为10-5mol/L,根据KSP[Al(OH)3]=c(Al3+)×c3(OH-)=2×10-33计算c(OH-),再根据水的离子积计算c(H+);
(4)根据关系式:Cr2O3~Na2Cr2O7计算.
解答 解:以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应,水浸过滤分离,滤液为Na2CrO4、Na2SiO3、NaAlO2的溶液,过滤得到滤渣为氧化铁,调节溶液pH是硅酸根、偏铝酸根转化为硅酸、氢氧化铝沉淀,再过滤除去,得到Na2CrO4溶液,滤液中加入硫酸酸化生成重铬酸钠溶液,再经过加热浓缩、冷却结晶、过滤等操作得到重铬酸钠.
(1)高温焙烧后粉碎,增大接触面积,提高水浸效率;调节pH,Na2SiO3、NaAlO2可生成H2SiO3、Al(OH)3沉淀过滤除去,
故答案为:增大接触面积,提高水浸效率;H2SiO3、Al(OH)3;
(2)铬矿石中加入碳酸钠和氧气高温灼烧发生反应生成铬酸钠、二氧化碳,反应的化学方程式为2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2,在酸性环境下,CrO42-转化为Cr2O72-,反应离子方程式为:2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2;2CrO42-+2H+?Cr2O72-+H2O;
(3)Al3+沉淀完全的浓度为10-5mol/L,根据KSP[Al(OH)3]=c(Al3+)×c3(OH-)=2×10-33,可知c(OH-)=0.58×10-9mol/L,则c(H+)=$\frac{1{0}^{-14}}{0.58×1{0}^{-9}}$mol/L=1.7×10-5mol/L,
故答案为:1.7×10-5;
(4)设该矿石中铬元素的质量分数为y,则:
Cr2O3~~~~~Na2Cr2O7
152 262
10.4t×y 10.218t
所以152:262=10.4t×y:10.218t
解得y=57%,
故答案为:57%.
点评 本题考查物质制备工艺流程,涉及对操作与反应原理的分析评价、物质的分离提纯、溶度积有关计算、化学计算计算等,侧重于学生分析应用及计算能力的考查,综合性较强,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 异常情况 | 可能原因分析 |
| A | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
| B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C | 蒸馏:温度计读数达到了馏分的沸点且历时10分钟,锥形瓶中却无液体 | 温度计位置错误,或装置漏气,或冷凝水方向反了 |
| D | 检验Fe2+:加入KSCN溶液,溶液呈红色 | Fe2+已部分被氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-2c}{a}$ | D. | $\frac{2b-4c}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +(2n-1)H2O.
+(2n-1)H2O.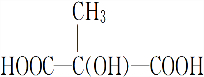 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com