
| A、NO2 |
| B、NO |
| C、N2O |
| D、NH4NO3 |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
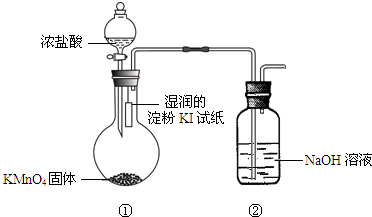 欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).
欲探究氯气与碘单质的氧化性强弱,某同学设计了如图装置(用浓盐酸和KMnO4固体反应制取氯气).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定相同温度下盐酸和醋酸溶液的pH,可证明盐酸是强酸、醋酸是弱酸 |
| B、改变温度能改变任何可逆反应的平衡状态 |
| C、离子反应的结果是自由移动的离子浓度减小 |
| D、Fe(OH)3胶体和饱和FeCl3溶液都呈红褐色,可通过丁达尔效应区分二者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO |
| B、BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeCl2 |
| C、Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
| D、BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5在空气中形成了气溶胶 |
| B、同温同压条件下,等质量的氧气和臭氧体积比为2:3 |
| C、16g臭氧中含有NA个原子 |
| D、1.00 mol臭氧中含有电子总数为18NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,2.24L氮气含有共用电子对数的0.5NA |
| B、22.4g铁粉完全溶于一定浓度的硝酸中,转移的电子数可能为0.6NA |
| C、4.6g甲醇和二甲醚(CH3-O-CH3)的混合物中所含分子数等于0.1NA |
| D、含Al3+数目为0.1NA的硝酸铝溶液中,NO3-个数大于0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com