
【物质结构与性质】
天冬酰胺(结构如右图)在芦笋中含量丰富,具有提高身体免疫力的功效。

(1)天冬酰胺所含元素中 (填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有 种。
(2)H2S和H2Se的参数对比见下表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3o | 一60.75 |
H2Se | 1.47 | 91.0o | 一41.50 |
①H2Se的晶体类型为 ,含有的共价键类型为 。
②H2S的键角大于H2Se的原因可能为 。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
A | 6990 | 9220 | 11500 | 18770 |
B | 6702 | 8745 | 15455 | 17820 |
C | 5257 | 6641 | 12125 | 13860 |
A是 (填元素符号),B的价电子排布式为 。
(1)氮 2
(2)①分子晶体 极性键
②由于S的电负性强于Se,形成的共用电子对斥力大,键角大
(3)Mn 3d54s1
【解析】(1)根据天冬酰胺结构可判断所含元素为C、H、N、O,价电子排布式分别为:2s22p2、1s1、2s22p3、2s22p4,未成对电子分别为:2、1、3、2,故氮元素未成对电子最多;从结构中看碳原子形成的化学键的类型有单键和双键,碳原子中碳以sp3和sp2杂化。
(2)①从表中数据看,H2Se沸点很低,故为分子晶体;H2Se中H和Se是不同的非金属原子,故形成的为极性共价键。
②从数据看,由于H-S键键长比H-Se键长短,两氢原子距离更近,斥力更强,因而H2S的键角更大(或由于S的电负性比Se大,使共用电子对间的排斥力变大,因而H2S的键角更大。
(3)钼和铬在同一副族,性质存在相似性和递变性,故电离能也存在相似性,B、C电离能变化相似,且铬的金属性小于钼,故铬的电离能比钼的相应要大,故B为铬,C为钼,A代表锰元素,元素符号为Mn,铬的价电子排布为3d54s1。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:推断题
甲酯除草醚(下图中E)是一种光合作用抑制剂,能被叶片吸收,但在植物体内传导速度较慢,它是芽前除草剂,主要用于大豆除草。某烃A合成E的路线如下:A
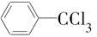


 B
B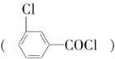

C D
D

(1)写出A、C的结构简式:A________;C________。
(2)写出C中官能团的名称:________________。
(3)写出下列反应的化学方程式:
反应⑤______________________________________________________;
反应⑥__________________________________________________________,
反应类型是____________________________________________________。
(4)C的同分异构体有多种。写出核磁共振氢谱有四种不同化学环境的氢,且峰面积比为1∶2∶2∶2的四种有机物的结构简式: _________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:实验题
某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:

查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作①的名称是 ;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、泥三角和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有 。
(3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为 , 操作④相关的化学方程式为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4+,该同学取少许滤液于试管中 (填写操作与现象),则证实滤液中含有NH4+。
(5)该同学利用在废旧干电池中回收的Zn片和石墨电极,设计一个原电池实验,比较铜与锌的金属活动性强弱。
限用材料:铜片、锌片、石墨电极、稀硫酸、CuSO4溶液、ZnSO4溶液;
限用仪器:直流电源、电流计、导线、烧杯、试管、盐桥等中学化学常见的药品和仪器
请画出实验装置图,并作相应标注,同时写出正极方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
向x mL 2.0 mol·L-1的盐酸中投入a g镁铝合金,金属完全溶解,再加入y mL 1.0 mol·L-1的NaOH溶液沉淀达到最大值,且质量为(a+1.7) g,则下列说法不正确的是
A.x=2y
B.镁铝合金与盐酸反应时转移电子的数目为0.1NA
C.镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12 L
D.a的取值范围为0.9 g<a<1.2 g
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是

A.该有机物的分子式为C7H7O3
B.该有机物能发生取代、加成和氧化反应
C.1 mol该有机物最多能与2 mol H2发生加成反应
D.该有机物的一种芳香族同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
相对分子质量为100的有机物A能与钠反应,且完全燃烧只生成CO2和H2O。若A含一个六碳环,则环上一氯代物的数目为( )
A、5 B、4 C、3 D、2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测14 题型:选择题
下表所列各组物质中,不能通过一步反应实现如图所示转化的是

物质 选项 | a | b | c |
A | Si | Na2SiO3 | SiO2 |
B | Fe | FeCl3 | FeCl2 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | Na2O2 | Na2CO3 | NaOH |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
分子式为C5H10N2O3的二肽在酸性条件下可水解为氨基酸(不考虑H2N-COOH和立体异构),这些氨基酸重新组合可形成的二肽共有
A.3种 B.6种 C.9种 D.12种
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列实验不能达到目的的是
选项 | 实验操作 | 实验目的 |
A | 向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/LNaCl溶液,产生白色沉淀;再向其中滴加3滴0.1mol/L的KI溶液,有黄色沉淀产生 | 验证Ksp(AgCl)> Ksp(AgI) |
B | 向适量样品溶液中滴加KSCN溶液 | 检验FeSO4溶液是否被氧化 |
C | 向适量样品溶液中滴加盐酸酸化,再滴加BaCl2溶液 | 检验Na2SO3溶液是否被氧化 |
D | 向Na2SiO3溶液中通入CO2 | 验证非金属性:碳>硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com