
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是 ( )
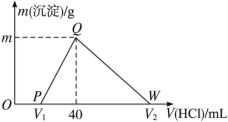
A.原合金质量为0.92 g B.图中V2为100
C.沉淀的质量m为1.56 g D.OP段发生的反应为:OH-+H+=== H2O
【答案】A
【解析】
试题分析:(1)2Na+2H2O=2NaOH+H2↑,2Al+2OH-+2H2O=2AlO2-+3H2↑,反应后pH=14,说明生成NaOH过量,此时n(OH-)=20×10-3×1mol=0.02mol,因此0~V1段发生的反应是H++OH-=H2O,此段消耗的盐酸的体积为0.02×103/1mL=20mL,PQ段发生反应是AlO2-+H++H2O=Al(OH)3↓,Q点溶质为NaCl,根据元素守恒,n(Na)=n(NaCl)=n(HCl)=40×10-3×1mol=0.04mol,合金与水反应后溶质为NaOH和NaAlO2,根据n(NaOH)=n(OH-)=0.02mol,根据Na元素守恒n(NaAlO2)=n(Na)-n(NaOH)=(0.04-0.02)mol=0.02mol,因此n(Al)=0.02mol,合金的质量为(0.04×23+0.02×27)g=1.46g,故说法错误;(2)QW段发生Al(OH)3+3H+=Al3++3H2O,消耗的n(H+)=3×n(Al)=3×0.02mol=0.06mol,即此段消耗盐酸的体积为0.06×1000/1mL=60mL,V2=100mL,故说法正确;C、沉淀是Al(OH)3,其质量为0.02×78g=1.56g,故说法正确;D、根据选项A的分析,故说法正确。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,探究氯碱工业原理,下列说法正确的是

A.石墨电极与直流电源负极相连
B.铜电极的反应式为:2H++2e-=H2↑
C.氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移
D.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示。下列说法不正确的是( )

A.开始时溶液pH=2是因为残留液中还有盐酸剩余
B.BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加
C.滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+)
D.AB发生的反应为:Ca2+ + CO32-== CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A(g)+B(g) ![]() C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。

①该反应是___________反应(填“吸热”、“放热”)。
②当反应达到平衡时,升高温度,A的转化率___________(填“增大”、“减小”或“不变”),原因是___________________
(2)(6分)把3molA和2.5molB混合,充入2L密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g),经5秒钟反应达到平衡,生成1 molD,并测得C的平均反应速率为0.1mol·L-1·s-1,则此反应中B的转化率为 ,C的化学计量数x为 ,A的平衡浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法正确的是
A.常温常压下,32gO2 、O3的混合物含有2Na个氧原子
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
C.1L1mol/L的盐酸溶液中含HCl分子数为1NA
D.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,常温常压下的水可瞬间结成冰,俗称“热冰”,下列说法正确的是( )
A.“热冰”与水的化学性质相同 B.“热冰”在任何条件下都不会融化
C.水结成“热冰”分子间的间隔变大 D.结成“热冰”后,分子停止运动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生化学课外兴趣小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,进行了下列实验探究。
【提出假设】
假设1:沉淀为CuCO3;
假设2:沉淀为 ;
假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2·mCuCO3]。
【查阅资料】这三种沉淀受热均易分解,都生成黑色固体CuO。
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如下装置(夹持仪器未画)进行定性实验;
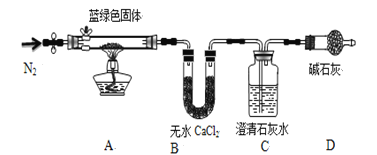
【问题讨论】
(1)假设2中的沉淀为 ,提出该假设的理论依据是 ,
(2)步骤1用无水乙醇洗涤,再风干的目的 ,
(3)装置D装有碱石灰的干燥管所起的作用是 ,
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明假设 (填写序号)一定不成立
(5)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,通过观察便可验证上述所有假设,该试剂是 (填代号)
A.浓硫酸 B.无水CuSO4 C.碱石灰 d.P2O5
(6)该小组经试验确定假设3成立,他们想进一步测定蓝绿色固体的化学式,丙同学查得一些物质在20℃的数据(如下表)后,建议将C中的澄清石灰水改为Ba(OH)2溶液,其原因是 (双选,填代号)
溶解度(s)/g | 溶度积(Ksp) | 摩尔质量(M)g/mol | |||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
a.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
(7)作上述调整后,若所取蓝绿色固体质量为27.1g,实验结束后装置B中无水氯化钙的质量增加2.7g,C中氢氧化钡溶液里产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 ,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH-
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH-![]() NH3↑+H2O
NH3↑+H2O
C.将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com