
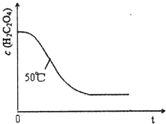
 某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.
某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
 ,故答案为:
,故答案为: .
.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若①正确,则溶液中溶质一定为NH4Cl |
| B、若③正确,则溶液中c(NH3?H2O)+c(NH4+)>c(Cl-) |
| C、若④正确,且该溶液是由盐酸和氨水等体积混合而成,则盐酸中c(H+)等于氨水中c(OH-) |
| D、上述四种关系式均可能成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
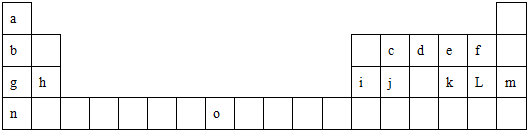
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
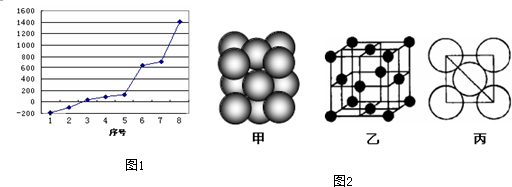
科目:高中化学 来源: 题型:
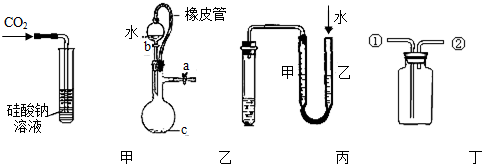
| A、甲装置:可用来证明碳的非金属性比硅强 |
| B、乙装置:橡皮管的作用是能使水顺利流下 |
| C、丙装置:用图示的方法不能检查此装置的气密性 |
| D、丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝与NaOH溶液反应:2Al+2 OH-+2H2O═2 AlO2-+3H2↑ |
| B、铁与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ |
| C、向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ |
| D、Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH |
| | |
| A、2种 | B、3种 | C、4种 | D、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠具有弱碱性,可治疗胃酸过多 |
| B、氧化镁熔点高,可做耐高温材料 |
| C、二氧化硫具有漂白性,可用于漂白纸浆和草帽辫 |
| D、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com