
| A.单质A晶体的熔沸点高,硬度较大? |
| B.A常见的化合物为+4价? |
| C.A的高价氧化物的水化物H2AO3的酸性比碳酸的酸性强? |
| D.A单质是良好的半导体材料? |
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源:不详 题型:单选题
| A.黑、红、蓝 | B.红、绿、黑褐 |
| C.蓝或绿、蓝、黑褐 | D.红、黑、黑褐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.碳和铜 | B.氟和氧 | C.碳和氢 | D.碳和硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
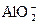 +3H2↑?
+3H2↑?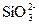 +2H2↑?
+2H2↑?查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ⅠA和ⅤA |
| B.ⅣA和ⅥA? |
| C.ⅡA和ⅥA |
| D.ⅠA和ⅥA? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硅是人类将太阳能转换为电能的常用材料 |
| B.粗硅制备单晶硅不涉及氧化还原反应 |
| C.石英玻璃和餐桌上的瓷盘都是硅酸盐制品 |
| D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.单质都是无色晶体 |
| B.单质中硅单质熔点最高 |
| C.碳族元素形成的化合物种类最多 |
| D.在化合物中最稳定的化合价都是+4价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com