
(14分)在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出) 请回答下列问题:

(1)形成单质D的元素在周期表中的位置
(2)形成C、D、F单质的元素半径由大到小的顺序(填写元素符号)
(3)C长期暴露在空气中,最终产物是
(4)H在高温下与碳反应方程式为 ,若转移4mol电子参加反应的碳为 mol。
(5)写出反应①的离子方程式
(6)写出反应②的化学方程式
(1)第三周期第 ;(2)Na>Cl>H;(3)Na2CO3 (4) SiO2+2C
;(2)Na>Cl>H;(3)Na2CO3 (4) SiO2+2C Si+2CO↑;
Si+2CO↑;
(5) Cl2 + 2OH--= Clˉ+ ClO-+H2O(2分)(6)Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl(2分)
【解析】
试题分析:根据题意可知:A 是NaCl;B是H2O;C是Na;D是Cl2;E是NaOH;F是H2;G是HCl;H是SiO2;I是Na2SiO3;K是NaClO;J是H2SiO3。(1)形成单质D的元素在周期表中的位置是第三周期第 ;(2)同一周期的元素,原子序数越大,原子半径就越小;不同周期的元素,原子核外电子层数越多,原子半径就越大,所以形成C、D、F单质的元素半径由大到小的顺序是Na>Cl>H;(3)C暴露在空气中,首先被氧化变为Na2O,Na2O与空气中的水发生反应产生NaOH,NaOH潮解变为溶液,溶液吸收CO2变为Na2CO3,所以最终产物是Na2CO3。(4) H在高温下与碳反应方程式为SiO2+2C
;(2)同一周期的元素,原子序数越大,原子半径就越小;不同周期的元素,原子核外电子层数越多,原子半径就越大,所以形成C、D、F单质的元素半径由大到小的顺序是Na>Cl>H;(3)C暴露在空气中,首先被氧化变为Na2O,Na2O与空气中的水发生反应产生NaOH,NaOH潮解变为溶液,溶液吸收CO2变为Na2CO3,所以最终产物是Na2CO3。(4) H在高温下与碳反应方程式为SiO2+2C Si+2CO↑;根据方程式可知每转移4mol的电子,反应消耗C单质的物质的量是2mol;(5)反应①的离子方程式是Cl2 + 2OH--= Clˉ+ ClO-+H2O;(6)反应②的化学方程式是Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl。
Si+2CO↑;根据方程式可知每转移4mol的电子,反应消耗C单质的物质的量是2mol;(5)反应①的离子方程式是Cl2 + 2OH--= Clˉ+ ClO-+H2O;(6)反应②的化学方程式是Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl。
考点:考查元素及化合物的知识。包括物质的推断、元素在周期表中的位置、原子半径大小比较、物质的保存及成分、化学方程式和离子方程式的书写的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
科技文献中经常出现的下列词汇,其中与相关物质的颜色并无联系的是
A.赤色海潮 B.棕色烟气 C.白色污染 D.绿色食品
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三第一次诊断性检测理综化学试卷(解析版) 题型:选择题
江西某铜业公司在火法炼铜时也生产硫酸,硫酸车间如图。下列叙述不正确的是

A.自然界化合态硫以FeS2、CuFeS2等形式存在
B.火法炼铜的矿石原料主要含Cu2S
C.该公司炼铜产生的SO2可用于生产H2SO4
D.l mol/L H2SO4溶液可储存于铁制或铝制容器
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。
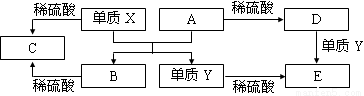
则下列说法正确的是
A.X与A反应的化学方程式是:Al2O3 + 2Fe Fe2O3 + 2Al
Fe2O3 + 2Al
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.HClO的电子式: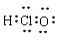
B.中子数为10的氧原子: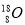
C.硝基苯的结构简式: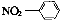
D.CH4分子的球棍模型:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列叙述错误的是
A.在18g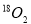 中含有
中含有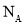 个氧原子
个氧原子
B.在反应KIO3+6HI =KI +3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D.25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:选择题
25℃时,向20 mL 0.2 mol/L H2A(某二元弱酸)溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)?根据图示判断,下列说法中正确的是

A.当V(NaOH)=20mL时,所得溶液中:c(OH-)> c(H+)
B.当V(NaOH)=30mL时,所得溶液中:2c(H+) + c(HA-) + 3c(H2A) = c(A2-) + 2 c(OH-)
C.当V(NaOH)=40mL时,所得溶液中:c(Na+)> c(A2-) >c(H+)> c(HA-) >c(OH-)
D.在NaHA溶液中:c(OH-)+2c(A2-) = c(H+)+2c(H2A)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:计算题
(本题共14分)某课外兴趣小组成员为研究金属铜与强酸的反应,将9.6克铜粉分为三等份,进行了如下一些实验,请完成有关计算。
54.取其中一份与100mL一定浓度的硝酸反应,待固体完全溶解,产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为0.896L。然后将剩余溶液稀释至1000mL,测得pH=0。请计算:生成的混合气体中一氧化氮的体积分数为______、反应前硝酸的物质的量浓度是__________。
55.再取另一份铜粉投入100mLpH=0的硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。求反应前混合溶液中所含硫酸的物质的量是多少?(写出计算过程)
56.用NaOH溶液吸收氮氧化物是防止NOx污染的一种方法。
原理为:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O
取最后一份铜粉溶于a mol/L过量的硝酸溶液30.0 ml中,假设硝酸的还原产物只有一氧化氮和二氧化氮。待反应结束后,将所剩溶液加水稀释至1000 m L,测得c(NO3-)=0.200 mol/L。若反应所生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
关于合成氨反应中平衡常数的讨论,一定正确的是
A.平衡常数越大,则H2转化率越大
B.平衡常数越小,则平衡向逆反应方向移动
C.只改变某一条件使平衡常数增大,则正反应速率增大
D.只改变某一条件使平衡常数减小,则H2转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com