
【题目】AA705合金(含![]() 和
和![]() )几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:
)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。回答下列问题:
(1)![]() 和
和![]() 中阳离子基态核外电子排布式为_____________________,
中阳离子基态核外电子排布式为_____________________,![]() 三种元素的第一电离能由大到小为_____________________;
三种元素的第一电离能由大到小为_____________________;
(2)以![]() 和抗坏血酸为原料,可制备
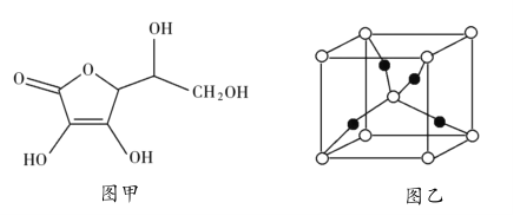
和抗坏血酸为原料,可制备![]() 。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_______________,推测抗坏血酸在水中的溶解性:_______________(填“难溶于水”或“易溶于水”),一个
。抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_______________,推测抗坏血酸在水中的溶解性:_______________(填“难溶于水”或“易溶于水”),一个![]() 晶胞(见图2)中,
晶胞(见图2)中,![]() 原子的数目为_______________;
原子的数目为_______________;
(3)![]() 和
和![]() 等配体都能与
等配体都能与![]() 形成配离子。
形成配离子。![]() 含______
含______![]() 键,中心离子的配位数为______________;
键,中心离子的配位数为______________;
(4)![]() 因杀虫效率高、廉价易得而被广泛应用。已知
因杀虫效率高、廉价易得而被广泛应用。已知![]() 的熔点为2000℃,其晶胞结构如图所示。
的熔点为2000℃,其晶胞结构如图所示。
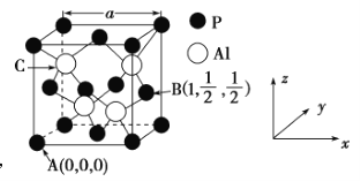
①磷化铝的晶体类型为______________,
②A、B点的原子坐标如图所示,则C点的原子坐标为___________,
③磷化铝的晶胞参数![]() ,其密度为____________
,其密度为____________![]() (列出计算式即可,用
(列出计算式即可,用![]() 表示阿伏加德罗常数的值);
表示阿伏加德罗常数的值);
(5)![]() 具有对称的立体构型,
具有对称的立体构型,![]() 中的两个
中的两个![]() 被两个
被两个![]() 取代,能得到两种不同结构的产物,则
取代,能得到两种不同结构的产物,则![]() 的空间构型为________________。
的空间构型为________________。
【答案】1s22s22p63s23p63d9或[Ar]3d9 Zn>Mg>Al sp3、sp2 易溶于水 4 16 4 原子晶体 (![]() ,
,![]() ,
,![]() )
) 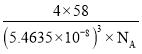 平面正方形
平面正方形
【解析】
(1)Cu原子失去4s能级上1个电子、3d能级上1个电子生成铜离子;Mg原子的3s轨道上的电子处于全充满状态,第一电离能比相邻元素大;
(2)饱和碳原子的杂化方式为sp3杂化,碳碳双键碳原子和酯基碳原子的杂化方式为sp2杂化;抗坏血酸分子中含有4个羟基,羟基属于亲水基,增大了抗坏血酸分子在水中的溶解性;由均摊法计算可得;
(3)所有单键包括配位键均为σ键,每个氨分子中含有3个N—H键,每个锌离子与4个氨分子中的N原子形成配位键;
(4)①由磷化铝的熔点为2000℃可知,磷化铝属于熔点很高的原子晶体;
②由A、B点的原子坐标可知,结合磷化铝的晶胞结构可以看出,Al原子位于立方体的体对角线的![]() 处;
处;
③由均摊法和质量公式计算可得;
(5)[Cu(NH3)4]2+具有对称的空间构型,则可能是平面正方形或是正四面体形。
(1)Cu原子失去4s能级上1个电子、3d能级上1个电子生成铜离子,则基态铜离子核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9;元素的金属性越弱,第一电离能越大,但Mg原子的3s轨道上的电子处于全充满状态,第一电离能比相邻元素大,则三种元素的第一电离能由大到小为Zn>Mg>Al,故答案为:1s22s22p63s23p63d9或[Ar]3d9;Zn>Mg>Al;
(2)由抗坏血酸的分子结构可知,分子中含有饱和碳原子、碳碳双键碳原子和酯基碳原子,其中饱和碳原子的杂化方式为sp3杂化,碳碳双键碳原子和酯基碳原子的杂化方式为sp2杂化;抗坏血酸分子中含有4个羟基,羟基属于亲水基,增大了抗坏血酸分子在水中的溶解性,则抗坏血酸易溶于水;该晶胞中白色粒子个数![]() 、黑色粒子个数为4,则白色粒子和黑色粒子个数之比=2:4=1:2,根据其化学式知,白色粒子表示O原子、黑色粒子表示Cu原子,则该晶胞中Cu原子数目为4,故答案为:sp3、sp2;易溶于水;4;
、黑色粒子个数为4,则白色粒子和黑色粒子个数之比=2:4=1:2,根据其化学式知,白色粒子表示O原子、黑色粒子表示Cu原子,则该晶胞中Cu原子数目为4,故答案为:sp3、sp2;易溶于水;4;
(3)所有单键包括配位键均为σ键,每个氨分子中含有3个N—H键,每个锌离子与4个氨分子中的N原子形成配位键,则1mol四氨合锌离子含有σ键的物质的量为(4×3+4)mol=16mol,配位数为4;故答案为:16;4;
(4)①由磷化铝的熔点为2000℃可知,磷化铝属于熔点很高的原子晶体,故答案为:原子晶体;
②由A、B点的原子坐标可知,结合晶胞结构可知Al原子位于立方体的体对角线的![]() 处,则C点的原子坐标为(
处,则C点的原子坐标为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );
);
③由晶胞结构可知,AlP晶胞中P原子位于顶点和面心,原子个数数是8×![]() +6×
+6×![]() =4,Al原子位于体内,原子个数是4,晶胞的体积为(5.463 5×10-8)3 cm3,则磷化铝的密度为
=4,Al原子位于体内,原子个数是4,晶胞的体积为(5.463 5×10-8)3 cm3,则磷化铝的密度为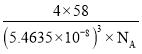 g·cm-3,故答案为:
g·cm-3,故答案为: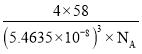 。
。
(5)[Cu(NH3)4]2+具有对称的空间构型,则可能是平面正方形或是正四面体型,由题意可知[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,说明[Cu(NH3)4]2+的空间构型为平面正方形,故答案为:平面正方形。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是( )
①过量的Zn与18 mol·L-1硫酸溶液反应 ②过量的氢气与少量的氮气在催化剂存在和一定条件下充分反应 ③过量的二氧化锰与浓盐酸 ④过量的铜与浓硫酸 ⑤过量的铜与稀硝酸 ⑥ 过量的稀硫酸与块状石灰石 ⑦常温下过量浓硫酸与铝
A.②③⑤B.②③④⑥⑦
C.①④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯库勒提出了有机物分子中碳原子为四价,而且可以互相结合成碳链的思想,为现代结构理论奠定了基础。1865年发表“论芳香族化合物的结构”论文,第一次提出了苯的环状结构理论。这一理论极大地促进了芳香族化学的发展和有机化学工业的进步。有关下列几种有机物叙述正确的是
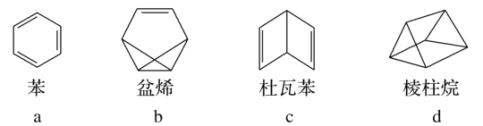
A.a、d互为同分异构体,b、c互为同系物
B.a和d的二氯代物均有3种,一氯代物均有1种
C.4种有机物均能使酸性高锰酸钾溶液褪色
D.a和b中所有原子可能共平面,c和d中所有原子都不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气3.36 L。则这两种金属不可能是( )
A.Al和FeB.Ag和AlC.Mg和AlD.Zn和Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的化工原料,以A为主要起始原料,通过下列途径可以合成高分子材料PA及PC。

试回答下列问题
(1)B的化学名称为_____________,B到C的反应条件是_____________;
(2)E到F的反应类型为_____________,高分子材料PA的结构简式为_____________;
(3)由A生成H的化学方程式为_______________________________________;
(4)实验室检验有机物A,可选择试剂_____________或_____________;
(5)E的同分异构中,既能与碳酸氢钠溶液反应又能发生银镜反应的有机物共有_____________种。其中核磁共振氢谱图有5组峰,且峰面积之比为6:1:1:1:1的物质的结构简式为_____________;
(6)由B通过三步反应制备1,3-环己二烯的合成路线为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素推断题。
根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
A | 第三周期VIIA族 |
B | 族序数是周期数的3倍 |
C | 原子序数是11 |
D | D3+与Ne的电子数相同 |
(1)A、B的元素符号分别为_______、________,C、D的元素名称分别为________、_______。B、D两元素在周期表中所在的位置分别是________、____________。
(2)写出B、C的单质在加热时的反应方程式:_____________。
(3)从原子结构的角度分析,C原子与D原子的__________相同。写出A的单质与水反应的离子方程式_______________,D的单质与C的氧化物的水化物溶液反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的氢氧化钠溶液,测得生成的气体(标准状况,下同)体积为b L,样品中铝的质量是______________g。
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:_______________________,氧化铁与铝的质量比是_____________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b__________。
(4)用铝热法还原下列物质,制得金属各1mol,消耗铝最少的是____________
A.MnO2 B.Fe3O4 C.Cr2O3 D. V2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是某品牌饮用矿泉水标签的部分内容。

请认真阅读标签内容,计算:
(1)镁离子的物质的量浓度的最大值_______。
(2)一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过多少_______?(单位:mol)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com