
| A. | 乙烯的结构简式:CH2CH2 | B. | 丙烯的键线式: | ||
| C. | 乙醇的结构式: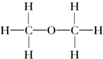 | D. | 甲烷的电子式: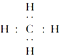 |
分析 A.乙烯中含有碳碳双键,所以其结构简式中应体现其官能团;
B.键线式是以短线代替碳碳共价键,短线折点代替碳原子的一种有机物结构表达方式;
C.乙醇中含有CH3CH2-和-OH;
D.甲烷是共价化合物,碳原子和氢原子之间形成共价单键.
解答 解:A.乙烯中含有碳碳双键,所以乙烯的结构简式为CH2=CH2,故A错误;
B.丙烯的键线式: ,故B错误;
,故B错误;
C.乙醇中含有CH3CH2-和-OH,结构式为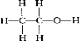 ,故C错误.
,故C错误.
D.甲烷是共价化合物,碳原子和氢原子之间形成共价单键,碳原子与氢原子之间形成1对共用电子对,电子式为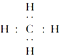 ,故D正确;
,故D正确;
故选D.
点评 本题考查化学用语,难度不大,注意键线式是以短线代替碳碳共价键,短线折点代替碳原子的一种有机物结构表达方式.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:解答题
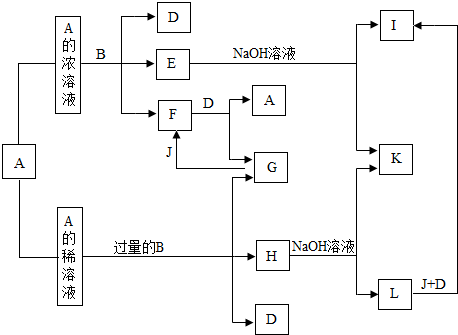
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 适当增大压强 | ||
| C. | 加入催化剂 | D. | 从容器中分离出氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用大量SO2漂白银耳 | |
| B. | 用小苏打(NaHCO3)焙制糕点 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| D. | 用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
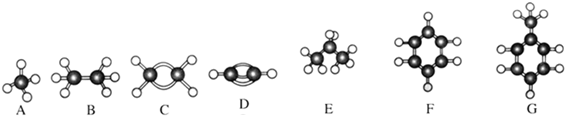
| 试剂 | |
| 乙烷混有少量乙烯 | |
| 溴苯混有少量溴单质 |
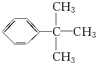 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为同位素的两种原子 | B. | 两种不同元素的原子 | ||
| C. | 一种原子和一种离子 | D. | 一种阴离子和一种阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥⑦ | B. | ①②④⑤⑥ | C. | ②④⑤⑥⑦ | D. | ②④⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com