
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
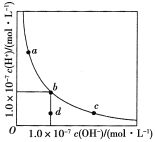
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,通入HCl可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
科目:高中化学 来源: 题型:
【题目】Ⅰ.是一种重要的有机合成中间体,由芳香烃A和E为有机原料和其他必要试剂制备Ⅰ的合成路线如图:
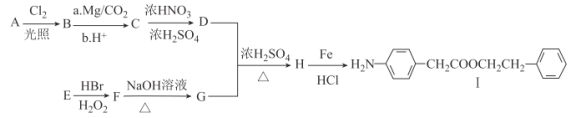
已知:Ⅰ.RX![]() RCOOH;
RCOOH;
Ⅱ.R—CH=CH2![]() R—CH2CH2Br;
R—CH2CH2Br;
Ⅲ.![]() 。
。
请回答下列问题:
(1)A的分子式为___。Ⅰ中含有官能团的名称为_____。
(2)C→D、H→I的反应类型分别为____、____。
(3)E的化学名称为______,一定条件下,E发生加聚反应的化学方程式为____。
(4)F→G的化学方程式为____。
(5)H的结构简式为____。
(6)同时满足下列条件的C的同分异构体有__种(不考虑立体异构);其中核磁共振氢谱有5组峰的结构简式为____。
①能与FeCl3溶液发生显色反应
②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 __________mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx→N2+CO2(未配平),若x=1.5,则方程式中CO2和N2的化学计量数之比为______。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
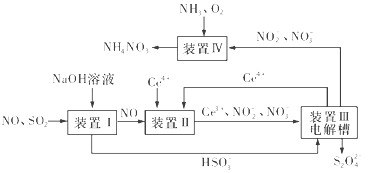
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律。

(1)仪器A的名称为_____,干燥管 D 的作用为_____。
(2)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B 中装有![]() 固体,则 A中试剂为______,观察到 C 中溶液_____(填现象),即 可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶 液吸收尾气。
固体,则 A中试剂为______,观察到 C 中溶液_____(填现象),即 可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶 液吸收尾气。
(3)若要证明非金属性:C>Si,则在 A中加盐酸、B 中加![]() 、C 中加
、C 中加![]() 溶液。观察到 C 中溶液_____(填现象),即可证明。但有的同学认 为盐酸具有挥发性,HCl可进入 C 中干扰实验,应在两装置间添加装有__________________溶液的洗气瓶除去。
溶液。观察到 C 中溶液_____(填现象),即可证明。但有的同学认 为盐酸具有挥发性,HCl可进入 C 中干扰实验,应在两装置间添加装有__________________溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知五种元素的原子序数的大小顺序为 C>A>B>D>E,A、C同周期,B、C 同主族;A与B形成离子化合物,![]() 中所有的离子的电子数相同, 其电子总数为 30;D 和 E 可形成 5核10电子的分子。试回答下列问题:
中所有的离子的电子数相同, 其电子总数为 30;D 和 E 可形成 5核10电子的分子。试回答下列问题:
(1)写出下列物质的电子式:
![]() 的电子式:____________________;A、B、E形成的化合物:____________________;
的电子式:____________________;A、B、E形成的化合物:____________________;
(2)A、B 两元素组成的化合物![]() 存在的化学键是__________________________________。
存在的化学键是__________________________________。
(3)写出 D 和 E 形成的 5 核 10 电子分子与氯气的第一步反应的方程式:___________________________________________________。
Ⅱ.对下列物质进行分类(均填序号)。互为同素异形体的是________________;互为同分异构体的是________________;互为同系物的是________________.
①![]() 和
和![]() ;②
;②![]() 与
与![]() ;③
;③![]() 和
和![]() ;④金刚石与水晶; ⑤正戊烷和异戊烷 ⑥
;④金刚石与水晶; ⑤正戊烷和异戊烷 ⑥![]() 和
和 ![]() ⑦
⑦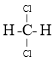
 ;⑧
;⑧![]() 与
与![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgO,MgSO4和MgHPO4组成的混合物中镁元素的质量分数为33%,则混合物中氧元素的质量分数为( )
A.16%B.32%C.49%D.55%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下列说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO![]()
D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下面列出了几组物质:①金刚石与“足球烯”C60;②D2O与H2O;③16O、18O;④氧气与臭氧;⑤ 与
与 ;⑥CH3CH2CH2CH3和
;⑥CH3CH2CH2CH3和![]() ;⑦CH4和CH3CH2CH3;⑧CH3CH3和
;⑦CH4和CH3CH2CH3;⑧CH3CH3和![]() 。
。
其中互为同位素的是______;互为同素异形体的是_____;属于同系物的是_____;互为同分异构体______。
II、写出下列有机物的系统命名或结构简式:
(1)(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3_______。
(2)  _______。
_______。
(3)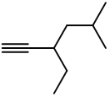 _____。
_____。
(4)2-甲基-2-丁烯_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种基础化工原料,可以用多种方法合成。
(1)用CO2生产甲醇。
已知:①CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
②2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1; (a、b均>0)
则表示CH3OH(g)燃烧的热化学方程式为:____________。
要使反应①在一定条件下建立的平衡逆向移动,可采取的措施有_______(填写字母序号)。
a.缩小反应容器的容积
b.扩大反应容器的容积
c.升高温度
d.使用合适的催化剂
e.从平衡体系中及时分离出CH3OH
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ![]() CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
(3)CO2在工业上有多种用途,其中之一是合成低碳烯烃。在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和 CO2平衡转化率的影响如图所示:
C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和 CO2平衡转化率的影响如图所示:
①图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是__________。
②250 ℃时,该反应的平衡常数K值为__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com