
分析 金属的冶炼一般有电解法、热还原法、热分解法、物理分离法
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得,
物理分离法:Pt、Au用物理分离的方法制得.
解答 解:(1)Al是活泼金属,因为氯化铝是共价化合物,熔融状态下不导电,所以工业上采用电解熔融氧化铝的方法冶炼,2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:③;
(2)由Fe、Zn、Cu等中等活泼金属用热还原法,即以C、CO或H2做还原剂还原冶炼,铁用热还原法3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,故答案为:②.
点评 本题考查金属冶炼,明确金属活泼性强弱与冶炼方法关系是解本题关键,会根据金属活泼性强弱选取合适的冶炼方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将水垢置于盛食醋的试管中 | 有气泡产生 | 醋酸的酸性比碳酸强 |
| B | 用湿润的蓝色试纸检验某气体 | 试纸变红 | 气体是酸性氧化物 |
| C | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | NaHCO3不溶于水 |
| D | 向酚酞溶液中加少量Na2O2 | 溶液变红 | Na2O2是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
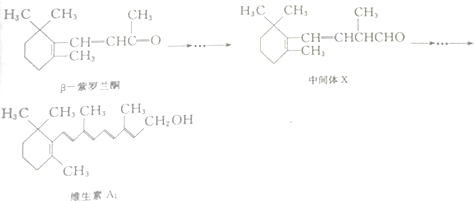
| A. | β-紫罗兰酮在核磁共振氢谱图中有7组峰 | |
| B. | β-紫罗兰酮与中间体X互为同分异构体 | |
| C. | 1mol中间体X最多能与2mol H2发生加成反应 | |
| D. | 维生素A1能发生取代反应、加成反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1molNH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①④ | C. | ③⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是焓变为负值 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为CO2(g)+H2(g) $?_{高温}^{催化剂}$ CO(g)+H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com