
【题目】下列仪器中,都能用于直接加热的一组是( )
A. 烧杯和量筒B. 试管和坩埚
C. 烧瓶和烧杯D. 试管和锥形瓶
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色. 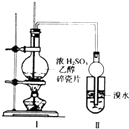
(1)写出该实验中生成乙烯的化学方程式:
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 .
A.乙烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后认为:
试管中另一现象可证明反应中有乙烯生成,这个现象是 . 为验证这一反应是加成而不是取代,可用PH试纸来测试反应后溶液的酸性,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的氮肥,合成原理为:N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
2NH3(g)△H=﹣92.4kJ/mol.回答下列问题:
(1)写出平衡常数K的表达式 , 如果降低温度,该反应K值 , 化学反应速率 , N2的转化率(填“增大”、“减小”或“不变”).
(2)在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题: 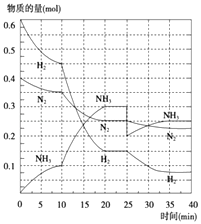
①10min内以NH3表示的平均反应速率: .
②在10~20min内,NH3浓度变化的原因可能是
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
③第1次达到平衡的时间为: , 第2次达到平衡的时间为:;
④在反应进行至25min时,曲线发生变化的原因
A.缩小容器体积 B.降低温度 C.分离了部分NH3
达第二次平衡时,新平衡的平衡常数K2K1 ,
(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人们的日常生活密切相关,下列叙述正确的是
A.二氧化硅是制造玻璃、光导纤维的原料
B.纤维素、油脂是天然有机高分子化合物
C.白菜上洒少许福尔马林,既保鲜又消毒
D.NOx、CO2、PM2.5颗粒都会导致酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有NaBr、KI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是
A. KCl B. NaCl、KCl C. NaCl、KBr D. NaCl、KCl、I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将X和Y 各0.16mol充入10L 恒容密闭容器中,发生反应:2X(g)+Y(s)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表下列说法正确的是( )
t/s | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.10 | 0.09 | 0.09 |
A.反应前2s的平均速率v(Z)=2.0×10﹣3 mol/(Ls)
B.其他条件不变,加入一定量的Y,反应速率一定加快
C.反应进行4s时,X的转化率75%
D.反应达到平衡时,X的物质的量浓度为0.02molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学耗氧量(Chemical Oxygen Demand,简称COD),是一个量度水体受污染程度的重要指标.废水中的还原性物质大部分是有机物,COD表示为氧化这些还原性物质所需消耗的O2的量(以mgL﹣1记).下面是用KMnO4法测定水样中COD的实验: 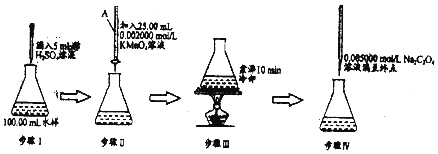
已知:步骤 IV 的离子反应为2MnO4﹣+5C2C42﹣+16H+=2Mn2++10CO2↑+8H2O
(1)步骤Ⅱ滴定管中注入酸性高锰酸钾前,先用蒸馏水洗净,再 .
(2)步骤 IV实验过程中滴入第一滴Na2C2O4溶液时褪色较慢,以后的滴定中褪色较快,原因是 .
(3)若步骤 IV所用Na2C2O4溶液为20.00mL,根据相关数据计算该水样的化学耗氧量COD(以mgL﹣1记).写出计算过程 .
(4)若实验测量结果(COD值)比实际值偏高,可从以下两个方面猜想:
猜想1:水样中Cl﹣影响;
猜想2:步骤 IV其他操作都正确,滴定终点(填“仰”“俯”)视读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是______________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式____________________________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在对水消毒时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有_____________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法
表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:
NaClO3+ HCl(浓)- ClO2↑+ Cl2↑+ H2O+ NaCl.
①配平方程式:______________。
②浓盐酸在反应中显示出来的性质是__________________(填序号)。
A.还原性 B.氧化性 C.酸性
③若上述反应中产生0.1molClO2,则转移的电子数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com