
分析 发生反应:3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.5L×0.2 mol•L-1=0.1 mol,由方程式可知Cu完全反应,根据Cu计算生成NO物质的量、消耗硝酸物质的量,进而计算剩余硝酸物质的量,再根据V=nVm计算NO体积,根据c=$\frac{n}{V}$计算氢离子浓度.
解答 解:(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.5L×0.2 mol•L-1=0.1 mol,
由3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑可知,稀硝酸过量,Cu完全反应,
(1)设生成的一氧化氮物质的量为x,消耗HNO3的物质的量为y,则:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 8 2
0.03mol y x
(1)生成NO的物质的量x=$\frac{0.03mol×2}{3}$=0.02mol,标准状况下所占的体积为0.02mol×22.4L/mol=0.448L,
答:标准状况下所占的体积为0.448L;
(2)消耗硝酸的物质的量y=$\frac{0.03mol×8}{3}$=0.08mol,则反应后溶液中H+的物质的量浓度是$\frac{0.1mol-0.08mol}{0.5L}$=0.04mol/L,
答:反应后溶液中H+的物质的量浓度是0.04mol/L.
点评 本题考查化学反应方程式的计算,明确发生的反应即可解答,注意对化学方程式意义理解,掌握以物质的量为中心的计算,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | 实验原理 | |
| A | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
| B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
| D | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先滴加氯水,再滴加KSCN溶液后显红色 | |
| B. | 先滴加KSCN溶液,不显红色,再滴加氯水后显红色 | |
| C. | 滴加NaOH溶液,产生灰绿色沉淀,最后呈红褐色 | |
| D. | 只需滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
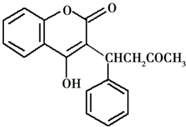
| A. | 灭鼠灵的分子式为C19H17O4 | |
| B. | 灭鼠灵可与溴水发身加成反应 | |
| C. | 分子中所有的碳原子都可能在同一个平面上 | |
| D. | 1 mol灭鼠灵最多可与8 mol H2 反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 量取10.08 mL 0.1 mol•L-1 NaHCO3溶液用碱式滴定管量取 | |
| B. | 为测定新制氯水的 pH,用玻璃棒蘸取液体滴在 pH 试纸上,与标准比色卡对照即可 | |
| C. | 探究催化剂对 H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 | |
| D. | 已知 4H++4I-+O2=2I2+2H2O,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol•L-1 KI 溶液、0.1 mol•L-1 稀硫酸外,还需要用到淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH HCl>CH3COOH | |
| B. | c(Cl-)=c(CH3COO-) | |
| C. | 等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 | |
| D. | 用同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,消耗的NaOH溶液体积一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com