
ΓΨΧβΡΩΓΩΘ®1Θ©œ¬Ν–ΗςΆΦΨυΡή±μ ΨΦΉΆιΒΡΖ÷Ή”ΫαΙΙ,Α¥“Σ«σΜΊ¥πœ¬Ν–Έ Χβ:

ΔΌ…œ ωΡΡ“Μ÷÷ΗϋΡήΖ¥”≥Τδ’φ Β¥φ‘ΎΉ¥Ωω________ (ΧνΉ÷ΡΗ,œ¬Ά§)ΓΘ
a.Δώ b.Δρ c.Δσ d.Δτ
ΔΎœ¬Ν– ¬ ΒΡή÷ΛΟςΦΉΆιΖ÷Ή” «’ΐΥΡΟφΧεΫαΙΙΒΡ «_____ΓΘ
a.CH3Cl÷Μ¥ζ±μ“Μ÷÷Έο÷ b.CH2Cl2÷Μ¥ζ±μ“Μ÷÷Έο÷
c.CHCl3÷Μ¥ζ±μ“Μ÷÷Έο÷ d.CCl4÷Μ¥ζ±μ“Μ÷÷Έο÷
Θ®2Θ©ΧΰΖ÷Ή”÷–ΒΡΧΦ‘≠Ή””κ«β‘≠Ή”ΫαΚœΒΡΖΫ Ϋ «_____ΓΘ
a.–Έ≥…4Ε‘Ι≤”ΟΒγΉ”Ε‘
b.Ά®Ιΐ1ΗωΙ≤ΦέΦϋ
c.Ά®Ιΐ2ΗωΙ≤ΦέΦϋ
d.Ά®ΙΐάκΉ”ΦϋΚΆΙ≤ΦέΦϋ
Θ®3Θ©““ΆιΒΡΒγΉ” ΫΈΣ__________Θ§Ζ÷Ή” ΫΈΣCmH20ΒΡΆιΧΰ÷–mΈΣ________Θ§Ζ÷Ή” ΫΈΣC8HnΒΡΆιΧΰ÷–nΈΣ________Θ§”κCO2ΟήΕ»(Ά§Έ¬Ά§―Ι)œύΆ§ΒΡΆιΧΰΖ÷Ή” ΫΈΣ____Θ§»τ…œ ωΥΡ÷÷ΧΰΗςΈΣ1molΘ§‘ΎΉψΝΩO2÷–»Φ…’Θ§œϊΚΡO2ΉνΕύΒΡ «_____ΓΘ
Θ®4Θ©»τCH4ΓΔC2H6ΓΔC3H8ΓΔC4H10ΥΡ÷÷ΧΰΗςΈΣ1gΘ§‘ΎΉψΝΩO2÷–»Φ…’Θ§œϊΚΡO2ΉνΕύΒΡ «_____ΓΘ
ΓΨ¥πΑΗΓΩd b b ![]() 9 18 C3H8 C9H20 CH4
9 18 C3H8 C9H20 CH4
ΓΨΫβΈωΓΩ
Θ®1Θ©ΔΌ’βΦΗ÷÷–Έ Ϋ÷–Θ§Ζ÷Ή”ΫαΙΙ Ψ“βΆΦΓΔ«ρΙςΡΘ–ΆΦΑΧν≥δΡΘ–ΆΨυΡήΖ¥”≥≥ωΦΉΆιΖ÷Ή”ΒΡΩ’ΦδΫαΙΙΘ§ΒγΉ” Ϋ÷ΜΖ¥”≥‘≠Ή”ΉνΆβ≤ψΒγΉ”ΒΡ≥…Φϋ«ιΩωΘ§ΒΪΤδ÷–Ω’ΦδΧν≥δΡΘ–ΆΗϋΡή–ΈœσΒΡ±μ¥ο≥ω«β‘≠Ή”ΓΔΧΦ‘≠Ή”ΒΡΈΜ÷ΟΦΑΥυ’Φ±»άΐΘ§Ι ¥πΑΗΈΣΘΚdΘΜ
ΔΎΈό¬έΦΉΆι «ΤΫΟφΙΙ–ΆΜΙ «’ΐΥΡΟφΧεΙΙ–ΆΘ§CH3ClΓΔCHCl3ΓΔCCl4ΕΦ÷Μ”–“Μ÷÷ΫαΙΙΘ§ΕχCH2Cl2‘Ύ’ΐΥΡΟφΧεΙΙ–Ά÷–÷Μ”–“Μ÷÷ΫαΙΙΘ§Εχ‘ΎΤΫΟφΙΙ–Ά÷–Ω…“‘”–ΝΫ÷÷ΫαΙΙΘ§Υυ“‘CH2Cl2÷Μ¥ζ±μ“Μ÷÷Έο÷ Θ§Ω…“‘≈–ΕœΦΉΆι”ΠΈΣ’ΐΥΡΟφΧεΫαΙΙΘ§Εχ≤Μ «ΤΫΟφΫαΙΙΘ§Ι ¥πΑΗΈΣΘΚbΘΜ
Θ®2Θ©ΧΰΖ÷Ή”÷–ΒΡΧΦ‘≠Ή”ΉνΆβ≤ψ”–4ΗωΒγΉ”Θ§ΒΪ«β‘≠Ή”ΉνΆβ≤ψ÷Μ”–1ΗωΒγΉ”Θ§Υυ“‘ΧΦ‘≠Ή””κ«β‘≠Ή”ΫαΚœΒΡΖΫ Ϋ÷ΜΡή–Έ≥…“ΜΕ‘Ι≤”ΟΒγΉ”Ε‘Θ§Φ¥“ΜΗωΙ≤ΦέΦϋΘ§Ι ¥πΑΗΈΣΘΚbΘΜ
Θ®3Θ©““ΆιΖ÷Ή”÷–ΧΦ‘≠Ή””κ«β‘≠Ή”Ά®Ιΐ“ΜΕ‘Ι≤”ΟΒγΉ”Ε‘œύΝ§Ϋ”Θ§ΧΦ‘≠Ή””κΧΦ‘≠Ή”÷°Φδ“≤Ά®Ιΐ“ΜΕ‘Ι≤”ΟΒγΉ”Ε‘œύΝ§Ϋ”Θ§Υυ“‘““ΆιΒΡΒγΉ” ΫΈΣ![]() ΘΜΆιΧΰΒΡΆ® ΫΈΣCnH2n+2Θ§Ζ÷Ή” ΫΈΣCmH20ΒΡΆιΧΰ÷–mΈΣ
ΘΜΆιΧΰΒΡΆ® ΫΈΣCnH2n+2Θ§Ζ÷Ή” ΫΈΣCmH20ΒΡΆιΧΰ÷–mΈΣ![]() =9Θ§Ζ÷Ή” ΫΈΣC9H20ΘΜΖ÷Ή” ΫΈΣC8HnΒΡΆιΧΰ÷–nΈΣ
=9Θ§Ζ÷Ή” ΫΈΣC9H20ΘΜΖ÷Ή” ΫΈΣC8HnΒΡΆιΧΰ÷–nΈΣ![]() =18Θ§Ζ÷Ή” ΫΈΣC8H18ΘΜΗυΨίΑΔΖϋΦ”Β¬¬όΕ®¬…Ω…÷ΣΘ§Ά§Έ¬Ά§―Ιœ¬Θ§ΟήΕ»÷°±»Β»”ΎΡΠΕϊ÷ ΝΩ÷°±»Θ§Υυ“‘”κCO2ΟήΕ»œύΆ§ΒΡΆιΧΰΒΡΡΠΕϊ÷ ΝΩΈΣ44g/molΘ§…ηΖ÷Ή”÷–ΧΦ‘≠Ή” ΐ «xΘ§”ΟΆιΧΰΒΡΆ® ΫΩ…Ν– Ϋ12x+2x+2=44Θ§ΫβΒΟx=3Θ§‘ρΖ÷Ή” ΫΈΣC3H8ΘΜ1mol C2H6ΓΔC9H20ΓΔC8H18ΓΔC3H8‘ΎΉψΝΩΒΡ―θΤχ÷–»Φ…’Θ§œϊΚΡ―θΤχΖ÷±πΈΣ3.5molΓΔ14molΓΔ12.5molΓΔ5molΘ§Υυ“‘œϊΚΡ―θΤχΉνΕύΒΡ «C9H20ΘΜ
=18Θ§Ζ÷Ή” ΫΈΣC8H18ΘΜΗυΨίΑΔΖϋΦ”Β¬¬όΕ®¬…Ω…÷ΣΘ§Ά§Έ¬Ά§―Ιœ¬Θ§ΟήΕ»÷°±»Β»”ΎΡΠΕϊ÷ ΝΩ÷°±»Θ§Υυ“‘”κCO2ΟήΕ»œύΆ§ΒΡΆιΧΰΒΡΡΠΕϊ÷ ΝΩΈΣ44g/molΘ§…ηΖ÷Ή”÷–ΧΦ‘≠Ή” ΐ «xΘ§”ΟΆιΧΰΒΡΆ® ΫΩ…Ν– Ϋ12x+2x+2=44Θ§ΫβΒΟx=3Θ§‘ρΖ÷Ή” ΫΈΣC3H8ΘΜ1mol C2H6ΓΔC9H20ΓΔC8H18ΓΔC3H8‘ΎΉψΝΩΒΡ―θΤχ÷–»Φ…’Θ§œϊΚΡ―θΤχΖ÷±πΈΣ3.5molΓΔ14molΓΔ12.5molΓΔ5molΘ§Υυ“‘œϊΚΡ―θΤχΉνΕύΒΡ «C9H20ΘΜ
Ήέ…œΥυ ωΘ§¥πΑΗΈΣΘΚ![]() ΘΜ9ΘΜ18ΘΜC3H8ΘΜC9H20ΘΜ
ΘΜ9ΘΜ18ΘΜC3H8ΘΜC9H20ΘΜ
Θ®4Θ©CH4ΓΔC2H6ΓΔC3H8ΓΔC4H10ΥΡ÷÷Χΰ÷–«βΒΡ÷ ΝΩΖ÷ ΐ¥”¥σΒΫ–ΓΈΣCH4ΘΨC2H6ΘΨC3H8ΘΨC4H10Θ§÷ ΝΩœύΆ§ ±Θ§Ζ÷Ή”÷–«β‘ΣΥΊΒΡ÷ ΝΩΖ÷ ΐ‘Ϋ¥σΘ§Άξ»Ϊ»Φ…’ ±œϊΚΡ―θΤχ‘ΫΕύΘ§Υυ“‘œϊΚΡ―θΤχΉνΕύΒΡ «CH4Θ§Ι ¥πΑΗΈΣΘΚCH4ΓΘ


 ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ
ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ –Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
–Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―–ΨΩ–‘―ßœΑ–ΓΉι”ΟNa2SO3”κΝρΥα»ή“Κ(ΝρΥα”κΥ°ΧεΜΐ±»1ΓΟ1)÷Τ±ΗSO2≤ΔΫχ–––‘÷ ΧΫΨΩ Β―ιΓΘ

Θ®1Θ©D÷–ΒΡ Β―ιœ÷œσ «_____________Θ§CΓΔE÷–»ή“ΚΕΦΆ …ΪΘ§Ζ÷±πΧεœ÷SO2________ΓΔ_______–‘÷ ΓΘ
Θ®2Θ©«κ‘ΎΖΫΩρ÷–Μ≠≥ω ’Φ·SO2“‘ΦΑΈ≤Τχ¥ΠάμΉΑ÷Ο(±ξœύΙΊ ‘ΦΝ)ΓΘ___________
Θ®3Θ©―–ΨΩ–ΓΉιΖΔœ÷B÷–”–ΑΉ…Ϊ≥ΝΒμΘ§ΈΣΝΥ«ε≥ΰ≥ΝΒμΒΡΈο÷ Θ§―–ΨΩ–ΓΉιΆυB÷–Φ”»κΙΐΝΩœΓ―ΈΥαΘ§≥ΝΒμ ≤Μ»ήΫβΘ§Ρψ»œΈΣΝτœ¬ΒΡ≥ΝΒμΈο «__________Θ§–Έ≥…ΗΟ≥ΝΒμΒΡΖ¥”ΠΖΫ≥Χ Ϋ”–ΘΚ_________________________________________________________________________________
ΈΣΝΥΫχ“Μ≤Ϋ―ι÷Λ≥ΝΒμ‘≠“ρΘ§―–ΨΩ–ΓΉιΝμ»ΓBaC12»ή“ΚΘ§Φ”»»÷σΖ–Θ§ά以ΦΑ ±Φ”»κ…ΌΝΩ±Ϋ“ΚΖβΘ§»ΜΚσ‘ΌΆ®SO2Θ§ΫαΙϊΖΔœ÷≥ΝΒμΝΩΦθ…ΌΘ§ΒΪ»‘”–«αΈΔΜκ Ή«ΓΘ―–ΨΩ–ΓΉιΗΡΫχAΉΑ÷ΟΘ®»γΆΦΘ©Θ§‘ΌΫχ–– Β―ιΘ§B÷–ΟΜ”–≥ωœ÷ΜκΉ«ΓΘœ¬Ν–ΤχΧεΩ…ΉςΈΣXΤχΧεΒΡ «_____________

AΘ°CO2 BΘ°NH3 CΘ°O3 DΘ°N2 EΘ°NO2
Θ®4Θ©SO2ΈΣΩ’ΤχΈέ»ΨΈοΘ§―–ΨΩ–ΓΉιΈΣ≤βΕ®Ρ≥ΙΛ≥ß«χΩ’Τχ÷–SO2ΒΡΚ§ΝΩΘ§»Γ10m3(±ξΉΦΉ¥Ωω)ΒΡΩ’ΤχΘ§ ΜΚ¬ΐΆ®ΙΐΉψΝΩδεΥ°÷–Θ§‘ΎΥυΒΟ»ή“Κ÷–Φ”»κΙΐΝΩΒΡBaC12»ή“ΚΘ§ΫΪ≤ζ…ζΒΡΑΉ…Ϊ≥ΝΒμœ¥Β”ΓΔΗ…‘οΘ§”ΟΒγΉ”≥Τ≥ΤΤδ÷ ΝΩΈΣ0.233gΘ§‘ρΘΚ
ΔΌ Φλ―ιœ¥Β”“―Ψ≠Η…ΨΜΒΡ Β―ι≤ΌΉς «_________________________________________________ΓΘ
ΔΎ ‘ΦΤΥψ¥ΥΩ’Τχ÷–SO2ΒΡ≈®Ε»(Ν–≥ωΦΤΥψ±μ¥ο Ϋ≤ΔΦΤΥψΫαΙϊΘ§ΫαΙϊΒΞΈΜ”Οmg/m3±μ Ψ)ΓΘ________________________________________________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦΥυ ΨΘ§ΒγΜ·―ß‘≠άμ”κΈΔ…ζΈοΙΛ“’œύΉιΚœΒΡΒγΫβΆ―œθΖ®Θ§Ω…≥ΐ»Ξ“ΐΤπΥ°ΜΣΒΡNO3-‘≠άμ «ΫΪNO3-ΜΙ‘≠ΈΣN2ΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
A. »τΦ”»ΥΒΡ «![]() »ή“ΚΘ§‘ρΒΦ≥ωΒΡ»ή“Κ≥ Φν–‘
»ή“ΚΘ§‘ρΒΦ≥ωΒΡ»ή“Κ≥ Φν–‘
B. ΡχΒγΦΪ…œΒΡΒγΦΪΖ¥”Π ΫΈΣΘΚ![]()
C. ΒγΉ””… ·ΡΪΒγΦΪΝς≥ωΘ§Ψ≠»ή“ΚΝςœρΡχΒγΦΪ
D. »τ―τΦΪ…ζ≥…![]() ΤχΧεΘ§άμ¬έ…œΩ…≥ΐ»Ξ
ΤχΧεΘ§άμ¬έ…œΩ…≥ΐ»Ξ![]() mol
mol![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNA±μ ΨΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΘ§œ¬Ν––π ω’ΐ»ΖΒΡ «
A.1molNH4ΘΪΚ§”–ΒΡΒγΉ” ΐΈΣ11NA
B.0.1L3mol/LΒΡNH4NO3»ή“Κ÷–ΒΣ‘≠Ή” ΐΒ»”Ύ0.6NA
C.≥ΘΈ¬œ¬Θ§92gNO2”κN2O4ΜλΚœΤχΧε÷–―θ‘≠Ή” ΐΈΣ2NA
D.ΝρΥαοß÷–Φ»Κ§”–άκΉ”ΦϋΘ§”÷Κ§”–Ι≤ΦέΦϋΘ§Εχ¬»Μ·οß÷–÷ΜΚ§”–άκΉ”Φϋ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫαΚœ‘ΣΥΊ÷ήΤΎ±μ,Άξ≥…œ¬Ν–Έ ΧβΓΘ

Θ®1Θ©‘Ύ‘ΣΥΊ÷ήΤΎ±μ÷–»Ϊ≤Ω «Ϋπ τ‘ΣΥΊΒΡ«χ”ρΈΣ_____________ΓΘ
a.A b.B c.C d.D
Θ®2Θ©IΚΆII‘ΣΥΊ–Έ≥…ΒΡΜ·ΚœΈοΒΡΜ·―ß ΫΈΣ_____Θ§“ΜΕ®Κ§”–____ΦϋΓΘ
Θ®3Θ©œ÷”–ΦΉΓΔ““ΝΫ÷÷ΕΧ÷ήΤΎ‘ΣΥΊ, “Έ¬œ¬,ΦΉ‘ΣΥΊΒΡΒΞ÷ ‘ΎάδΒΡ≈®ΝρΥαΜρΩ’Τχ÷–±μΟφΕΦΜα…ζ≥…÷¬ΟήΒΡ―θΜ·ΡΛ,““‘ΣΥΊ‘≠Ή”ΚΥΆβΒΎ»ΐ≤ψ”κΒΎ“Μ≤ψ…œΒΡΒγΉ” ΐœύΒ»ΓΘ
ΔΌΫΪΦΉΓΔ““ΝΫ‘ΣΥΊΒΡ‘ΣΥΊΖϊΚ≈Χν–¥‘Ύ…œΟφ‘ΣΥΊ÷ήΤΎ±μ÷–Ε‘”ΠΒΡΈΜ÷Ο__≤Δ–¥≥ωΦΉΒΞ÷ ”κNaOH»ή“ΚΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ____ΓΘ
ΔΎΦΉΓΔ““ΝΫ‘ΣΥΊ÷–,Ϋπ τ–‘Ϋœ«ΩΒΡ «_____(Χν‘ΣΥΊΟϊ≥Τ),Ω…“‘―ι÷ΛΗΟΫα¬έΒΡ Β―ι «____(Χν–ρΚ≈)ΓΘ
a.ΫΪ‘ΎΩ’Τχ÷–Ζ≈÷Ο“―ΨΟΒΡ’βΝΫ÷÷‘ΣΥΊΒΡΒΞ÷ Ζ÷±πΖ≈»κ»»Υ°÷–
b.ΫΪ’βΝΫ÷÷‘ΣΥΊΒΡΒΞ÷ ΖέΡ©Ζ÷±πΚΆœύΆ§≈®Ε»ΒΡ―ΈΥαΖ¥”Π
c.ΫΪ’βΝΫ÷÷‘ΣΥΊΒΡΒΞ÷ ΖέΡ©Ζ÷³eΚΆ»»Υ°Ής”Ο,≤ΔΒΈ»κΖ”ΧΣ»ή“Κ
d.±»Ϋœ’βΝΫ÷÷‘ΣΥΊΒΡΤχΧ§«βΜ·ΈοΒΡΈ»Ε®–‘
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
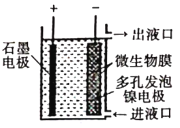
ΓΨΧβΡΩΓΩH2S¥φ‘Ύ”ΎΕύ÷÷»ΦΤχ÷–Θ§Ά―≥ΐ»ΦΤχ÷–H2SΒΡΖΫΖ®ΚήΕύΓΘ
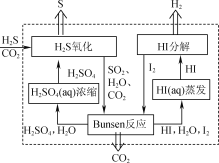
(1) 2019Ρξ3‘¬ΓΕscience directΓΖΫι…ήΒΡΜ·―ßΝ¥ΦΦ θΆ―≥ΐH2SΒΡ‘≠άμ»γΆΦΥυ ΨΓΘ
ΔΌΓΑH2S―θΜ·Γ±Ζ¥”Π÷–―θΜ·ΦΝ”κΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ________ΓΘ
ΔΎΓΑHIΖ÷ΫβΓ± ±Θ§ΟΩ1 mol HIΖ÷Ϋβ…ζ≥…Ββ’τΤχΚΆ«βΤχ ±Θ§Έϋ ’13 kJΒΡ»»ΝΩΘ§–¥≥ωΗΟΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΘΚ________ΓΘ
ΔέΓΑBunsenΖ¥”ΠΓ±ΒΡάκΉ”ΖΫ≥Χ ΫΈΣ________ΓΘ
(2) ΒγΜ·―ßΗ…Ζ®―θΜ·Ζ®Ά―≥ΐH2SΒΡ‘≠άμ»γΆΦΥυ ΨΓΘ―τΦΪΖΔ…ζΒΡΒγΦΪΖ¥”ΠΈΣ________ΘΜ“θΦΪ…œCOSΖΔ…ζΒΡΒγΦΪΖ¥”ΠΈΣ________ΓΘ
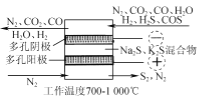
(3) ”ΟFe2(SO4)3Έϋ ’“ΚΆ―≥ΐH2SΖ®ΑϋΚ§ΒΡΖ¥”Π»γœ¬ΘΚ
(Δώ) H2S(g)![]() H2S(aq)
H2S(aq)
(Δρ) H2S(aq) ![]() HΘΪ+HS-
HΘΪ+HS-
(Δσ) HSΘ≠+2Fe3ΘΪ=SΓΐ+2Fe2ΘΪ+HΘΪ
“ΜΕ®ΧθΦΰœ¬≤βΒΟΆ―Νρ¬ ”κFe3ΘΪ≈®Ε»ΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ

ΔΌΈϋ ’“ΚΨ≠Ιΐ¬Υ≥ωSΚσΘ§¬Υ“Κ–ηΫχ––‘Ό…ζΘ§ΫœΨ≠ΦΟΒΡ‘Ό…ζΖΫΖ® «________ΓΘ
ΔΎΆΦ÷–Β±Fe3ΘΪΒΡ≈®Ε»¥σ”Ύ10 gΓΛLΘ≠1 ±Θ§≈®Ε»‘Ϋ¥σΘ§Ά―Νρ¬ ‘ΫΒΆΘ§’β «”…”Ύ________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥–ΘΆ§―ß…ηΦΤœ¬Ν– Β―ιΘ§ΧΫΨΩCaSΆ―≥ΐ―ΧΤχ÷–ΒΡSO2≤ΔΜΊ ’SΓΘ Β―ι≤Ϋ÷η»γœ¬ΘΚ
≤Ϋ÷η1.≥Τ»Γ“ΜΕ®ΝΩΒΡCaSΖ≈»κ»ΐΩΎ…’ΤΩ÷–≤ΔΦ”»κΦΉ¥ΦΉς»ήΦΝ(»γœ¬ΆΦΥυ Ψ)ΓΘ
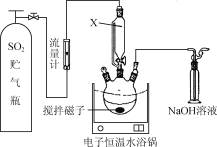
≤Ϋ÷η2.œρCaSΒΡΦΉ¥Φ–ϋΉ«“Κ÷–ΜΚΜΚΆ®»κ“ΜΕ®ΝΩΒΡSO2ΓΘ
≤Ϋ÷η3.Ιΐ¬ΥΘ§ΒΟ¬Υ“ΚΚΆ¬Υ‘ϋΓΘ
≤Ϋ÷η4.¥”¬Υ“Κ÷–ΜΊ ’ΦΉ¥Φ(Ζ–ΒψΈΣ64.7 Γφ)Θ§ΥυΒΟ≤–‘ϋ”κ≤Ϋ÷η3ΒΡ¬Υ‘ϋΚœ≤ΔΓΘ
≤Ϋ÷η5.”ΟCS2¥”¬Υ‘ϋ÷–ίΆ»ΓΜΊ ’ΒΞ÷ SΓΘ
(1) ΆΦ÷–”Ο“«ΤςX¥ζΧφΤ’Ά®Ζ÷“Κ¬©ΕΖΒΡΆΜ≥ω”≈Βψ «________________ΓΘ
(2) »ΐΩΎ…’ΤΩ÷–…ζ≥…ΝρΚΆ―«ΝρΥαΗΤΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________________Θ§»ΐΩΎ…’ΤΩ÷–ΉνΚσ≤–ΝτΙΧΧε÷–Κ§“ΜΕ®ΝΩΒΡCaSO4Θ§Τδ‘≠“ρ «________________ΓΘ
(3) ≤Ϋ÷η4ΓΑΜΊ ’ΦΉ¥ΦΓ±–ηΫχ––ΒΡ≤ΌΉςΖΫΖ® «________________ΓΘ
(4) ≤Ϋ÷η5ΈΣ Ι¬Υ‘ϋ÷–SΨΓΩ…Ρή±ΜίΆ»ΓΘ§Ω…≤…»ΓΒΡ≤ΌΉςΖΫΑΗ «________________ΓΘ
(5) «κ…ηΦΤ¥”…œ ωΜΊ ’ΒΡSΚΆΒΟΒΫΒΡΚ§Na2SO3Έϋ ’“Κ÷Τ±ΗNa2S2O3ΓΛ5H2OΒΡ Β―ιΖΫΑΗΘΚ
≥Τ»Γ…‘ΙΐΝΩΝρΖέΖ≈»κ…’±≠÷–Θ§__________________________________________Θ§”Ο¬Υ÷ΫΈϋΗ…ΓΘ
“―÷ΣΘΚΔΌ ‘Ύ“ΚΧεΖ–ΧΎΉ¥Χ§œ¬Θ§Ω…ΖΔ…ζΖ¥”ΠNa2SO3ΘΪSΘΪ5H2O![]() Na2S2O3ΓΛ5H2OΓΘ
Na2S2O3ΓΛ5H2OΓΘ
ΔΎΝρ≤Μ»ή”ΎNa2SO3»ή“ΚΘ§ΈΔ»ή”Ύ““¥ΦΓΘ
ΔέΈΣΜώΒΟ¥ΩΨΜ≤ζΤΖΘ§–η“ΣΫχ––Ά―…Ϊ¥ΠάμΓΘ
Δή–κ Ι”ΟΒΡ ‘ΦΝΘΚSΓΔNa2SO3Έϋ ’“ΚΓΔ““¥ΦΓΔΜν–‘ΧΩΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ÷”–ΧζΓΔΧΦΝΫ÷÷‘ΣΥΊΉι≥…ΒΡΚœΫπΘ§Ρ≥ Β―ι–ΓΉιΈΣΝΥ―–ΨΩΗΟΚœΫπΒΡ–‘÷ ≤Δ≤βΕ®ΗΟΚœΫπ÷–ΧΦΒΡ÷ ΝΩΖ÷ ΐΘ§…ηΦΤΝΥ»γΆΦ Β―ιΖΫΑΗΚΆ Β―ιΉΑ÷ΟΓΘ(“―÷ΣSO2Ρή”κΥα–‘KMnO4Ζ¥”Π…ζ≥…ΝρΥα―Έ)

I.ΧΫΨΩΗΟΚœΫπΒΡΡ≥–©–‘÷ ΘΚ
Θ®1Θ©»ΓagΚœΫπΖέΡ©Ζ≈»κ’τΝσ…’ΤΩΘ§≤ΔΦ”»κΉψΝΩ≈®H2SO4Θ§AΓΔB÷–ΨυΈόΟςœ‘œ÷œσΘ§‘≠“ρ «__ΘΜ
Θ®2Θ©Βψ»ΦΨΤΨΪΒΤ“ΜΕΈ ±ΦδΚσΘ§A÷–ΨγΝ“Ζ¥”ΠΘ§«κ–¥≥ω¥Υ ±ΚœΫπ÷–≥…Ζ÷ΧΦ≤Έ”κΒΡΜ·―ßΖ¥”ΠΖΫ≥Χ Ϋ__ΘΜ
Θ®3Θ©ΉΑ÷ΟDΒΡΉς”Ο «__ΘΜΉΑ÷ΟEΒΡΉς”Ο «__ΓΘ
II.≤βΕ®―υΤΖ÷–ΧΦΒΡ÷ ΝΩΖ÷ ΐΘΚ
Θ®4Θ©ΉΑ÷ΟFΒΡΉς”Ο__ΘΜ
Θ®5Θ©»τΖ¥”Π«ΑΚσEΉΑ÷ΟΒΡ÷ ΝΩΖ÷±π «m1ΚΆm2Θ§‘ρΚœΫπ÷–ΧΦΒΡ÷ ΝΩΖ÷ ΐ «__Θ§»τΟΜ”–Ν§Ϋ”DΉΑ÷ΟΜα Ι≤βΕ®ΫαΙϊ__Θ®ΧνΓΑΤΪ¥σΓ±ΓΑΤΪ–ΓΓ±ΓΑΈό”ΑœλΓ±Θ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNAΈΣΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΘ°œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
A. ΗΏΈ¬œ¬Θ§0.2 mol Fe”κΉψΝΩΥ°’τΤχΖ¥”ΠΘ§…ζ≥…ΒΡH2Ζ÷Ή” ΐΡΩΈΣ0.3NA
B. “Έ¬œ¬Θ§1 L pH=13ΒΡNaOH»ή“Κ÷–Θ§”…Υ°ΒγάκΒΡOH©¹άκΉ” ΐΡΩΈΣ0.1NA
C. «β―θ»ΦΝœΒγ≥Ί’ΐΦΪœϊΚΡ22.4 LΘ®±ξΉΦΉ¥ΩωΘ©ΤχΧε ±Θ§Βγ¬Ζ÷–Ά®ΙΐΒΡΒγΉ” ΐΡΩΈΣ2NA
D. 5NH4NO3![]() 2HNO3+4N2Γϋ+9H2OΖ¥”Π÷–Θ§…ζ≥…28 g N2 ±Θ§ΉΣ“ΤΒΡΒγΉ” ΐΡΩΈΣ3.75NA
2HNO3+4N2Γϋ+9H2OΖ¥”Π÷–Θ§…ζ≥…28 g N2 ±Θ§ΉΣ“ΤΒΡΒγΉ” ΐΡΩΈΣ3.75NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com