
2004年2月22日是第35个 “世界地球日”,我国确定的主题是“善待地球——科学发展”。下列行为中不符合这一主题的是( )
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
C.大量开采地下水,以满足社会对水的需求
D.节约能源,提高能源利用率
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
用惰性电极电解下列物质的溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全相同的是( )
A.CuCl2[CuO] B.NaOH[Na2O] C.NaCl[HCl] D.CuSO4[Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸溶液反应
②碳酸钙和足量稀盐酸反应
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①Zn+2H+==Zn2++H2↑
②HCO3-+ H+==CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
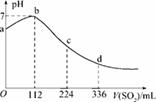 A.ab段反应是:SO2+2H2S===3S↓+2H2O
A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO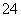 ,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
(2)酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式:
________________________________________________________________________。
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:
________________________________、________________________________________。
(4)向含有n mol 溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式:
_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于 0.2 mol/L 硝酸钾溶液的叙述中,正确的是 ( )
A.1 L 该溶液中含硝酸钾 202 g
B.100 mL 该溶液中含硝酸钾 0.02 mol
C.从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L
D.1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列说法不正确的是 ( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.25℃ 1.01×105 Pa,64 g SO2中含有的原子数为3NA
C.0℃ 101千帕,11.2L氮气所含的原子数目为NA
D.17g氨气所含电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol-1
② H2O(l) H2O(g) △H= + 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
| 方法一 | CO(g) +2H2(g) |
| 方法二 | CO2(g) +3H2(g) |
工业上可用如下方法合成甲醇:
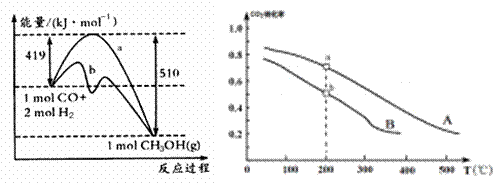
方法一 方法二
①方法一:该反应的△S 0(填“>”或“<”)。图中曲线a到曲线b的措施是
,恒温恒容时,下列说法能说明反应到达平衡状态的是 。
A.体系的平均摩尔质量不再改变 B. V(CO)= V(CH3OH)
C. H2的转化率达到了最大限度 D. △H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为: ;a,b两点化学反应速率别用Va、Vb表示,则Va Vb(填“大于”、“小于”或“等于”)。 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的
倍(保留两位小数).
甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.已知2NO2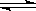 N2O4加压后颜色先变深后变浅。
N2O4加压后颜色先变深后变浅。
B. 在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小。
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小。
C.在密闭容器中进行如下反应:X2(g)+Y2(g) 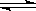 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L。
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L。
D. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是⑤⑥⑦⑧。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com