
【题目】在以稀硫酸为电解质溶液的铜﹣﹣锌原电池中,已知其电极反应分别为锌片:Zn﹣2e﹣=Zn2+;铜片:2H++2e﹣=H2↑.下列判断正确的是( )
A.溶液的酸性逐渐增强
B.铜片逐渐溶解
C.溶液中H+向锌片作定向移动
D.锌片是负极并被氧化
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是

A. 甲胺在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH—
CH3NH3++OH—
B. b点对应的加入盐酸的体积小于20mL
C. 将等物质的量的CH3NH2和CH3NH3Cl一起溶于蒸馏水,得到对应a点的溶液
D. 常温下,甲胺的电离常数为Kb,则pKb=—lgKb=3.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一套制取并验证氯气部分化学性质的实验装置。
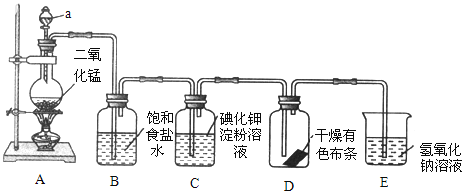
回答下列问题:
(1)装置 A 中,仪器 a 的名称叫_____,该仪器中盛放的试剂为_____,装置 B的作用是_____。
(2)装置 A 中发生反应的化学方程式是_____。
(3)当 Cl2 持续通过时,装置 D 中干燥的有色布条能否褪色?为什么?_____,____。
(4)若要证明干燥的 Cl2 无漂白性,可在装置 D 前添加一个装有_____的洗气瓶。
(5)装置 E 的作用是_____,该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述不正确的是
2AlN+3CO合成。下列叙述不正确的是
A. 上述反应中, C是还原剂,AlN是还原产物
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮元素的化合价为-3
D. AlN的摩尔质量为41
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了探究原电池反应,做了如下实验:将Al片和Zn片插入到Na2SO4溶液中,装置如下图。
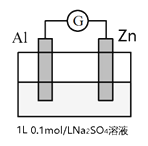
操作 | 现象 |
i接通电流计 | 接通开始之后指针向右偏且稳定;两极附近均没有明显现象。 |
ii向溶液中加入50mL 2mol/L H2SO4 | 开始时指针仍向右偏,Al、Zn表面均产生少量气泡;大约半分钟后,指针向左偏且稳定,Al、Zn表面均产生大量气泡。 |
下列说法不正确的是
A. i中指针向右偏时,Al的电极反应为:O2 + 4e- +2H2O = 4OH-
B. ii中开始时, Zn做负极,SO42-向Zn极移动
C. ii中半分钟后,装置中的反应为Al的析氢腐蚀和Al的化学腐蚀共存
D. 从上述实验中可以得出,Al在H2SO4中的还原性强于在Na2SO4中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用下图所示装置对Cl2与Na2S2O3溶液的反应进行探究(气密性已检验)。
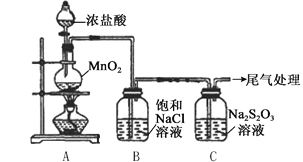
实验操作和现象:
操作 | 现象 |
打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i. A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii. 一段时间后,C中产生大量黄色沉淀。 |
用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查阅资料:a. S2O32-有较强的还原性
b. 酸性条件下S2O32-迅速分解为S和SO2
(1)A中发生反应的离子方程式是__________。
(2)B中饱和NaCl溶液的作用是_______。
(3)C中生成黄色沉淀的离子方程式是__________。
(4)为检验C中是否有SO2生成,需进行的操作是_______。
(5)C中滤液与氯化钡溶液反应生成白色沉淀,甲同学认为利用该现象可证明Na2S2O3被Cl2氧化,反应的离子方程式是__________。
(6)乙同学认为,C中滤液用硝酸酸化后滴加硝酸银溶液,若有白色沉淀,也能证明Na2S2O3被Cl2氧化,丙同学认为不能证明,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从理论上分析,关于Fe﹣CuSO4溶液﹣Cu原电池的叙述正确的是( )
A.铜极为负极
B.电子从铜沿导线转移到铁
C.铁表面析出金属铜
D.总反应为Fe+CuSO4=FeSO4+Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体中,出现丁达尔效应的分散系是( )
①早晨树林里的雾 ②牛奶 ③豆浆 ④H2SO4溶液 ⑤硫酸铜溶液
A.①②③B.②③④C.③④⑤D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com