
| A. | 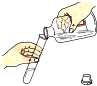 倾倒液体 | B. | 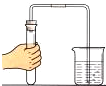 检查气密性 | C. | 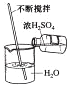 稀释浓硫酸 | D. | 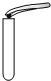 取用固体 |
分析 A.倾倒液体时应防止腐蚀标签;
B.可利用压强差检查气密性;
C.稀释浓硫酸应防止酸液飞溅;
D.取用固体药品,注意防止损害实验仪器.
解答 解:A.倾倒液体时,瓶塞倒放在桌面上,标签向着手心,试管要倾斜,试剂瓶口与试管口紧挨着,故A正确;
B.检查气密性方法:连接装置,将导管一端浸入水中,手握试管外壁,如果导管口有气泡冒出,说明气密性良好,故B正确;
C.稀释浓硫酸时,将浓硫酸沿着容器壁慢慢倒入水中,并用玻璃棒不断搅拌,故C正确;
D.取用固体时,先将试管横放,用药匙或镊子将药品放在试管口,再将试管竖起,故D错误.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及装置气密性检验、溶液的稀释以及药品的取用等,侧重实验基本操作和实验技能的考查,注意实验操作的评价性分析,题目难度不大


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SeO4的氧化性比Cl2弱 | B. | SeO2的氧化性比SO2弱 | ||
| C. | H2SeO4的氧化性比H2SeO3强 | D. | 浓H2SeO4的氧化性比HNO3强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).
H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).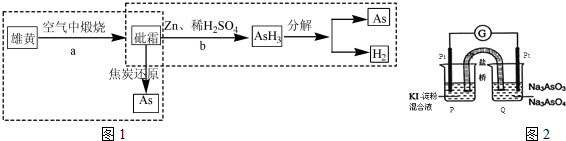
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
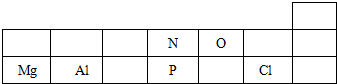
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑦ | ||||||
| 3 | ① | ③ | ④ | ⑥ | ⑧ | ⑨ | ⑩ | |
| 4 | ② |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
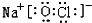 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 1 mol MgCl2固体溶于水中,所得氯离子的数目为NA | |
| D. | 17 g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于25% | B. | 大于25% | C. | 小于25% | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com