
| A. | 2VL | B. | VL | C. | 0.5VL | D. | 无法计算 |
分析 发生反应:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,H2、CO的混合气体VL,结合方程式可知,一定体积的混合气体耗氧量取决于V(CO+H2)的总量,与CO、H2的相对多少无关,以此解答.
解答 解:发生反应:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,H2、CO的混合气体VL,结合方程式可知,一定体积的混合气体耗氧量取决于V(CO+H2)的总量,而且消耗氧气的量是混合气体的量的$\frac{1}{2}$,所以完全燃烧时需O2的体积是0.5VL,故选C.
点评 本题考查混合物的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,根据方程式确定相同体积的CO、H2消耗氧气的体积相同是解题关键.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
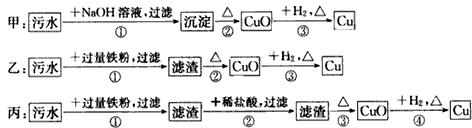
| A. | 三种实验方案中都能制得纯净铜 | |
| B. | 甲方案中的反应涉及置换、分解、复分解三种反应类型 | |
| C. | 乙方案中加过量铁粉只能还原其中的二种阳离子 | |
| D. | 丙方案不会产生环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
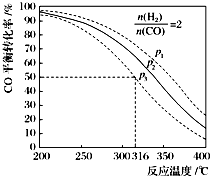 二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液显碱性 |
| Z | 短周期元素最高正化合价是+7价 |
| W | 3d能级电子数是最外层电子数的3倍 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
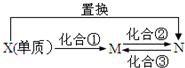 M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )
M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )| A. | X可以是Mg或Cu元素 | |
| B. | 化合②③的反应可以是非氧化还原反应 | |
| C. | 若X为C元素,则该转化关系中X单质发生的置换反应可以是2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| D. | 若X为Fe元素,则M的H218O溶液中加入固体Na2O2的反应为:4Fe3++6H218O+6Na2O2═4Fe(OH)3↓+12Na++318O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入一定量的H2O(g) | |
| D. | 保持压强不变,充入N2使容器体积变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com