
【题目】实验室用30%左右的硫酸溶液(约3.7 mol·L-1)与锌粒反应制取氢气。下列措施中不可能加快反应速率的是
A.适当升高温度B.将锌粒改为锌粉
C.将所用硫酸加适量水适当稀释D.寻找一种合适的催化剂并加入其中
科目:高中化学 来源: 题型:
【题目】甲酸铝广泛用于化工、石油等生产上,120150℃左右分解。在0℃时,溶解度为16g,100℃时,溶解度为18.4g。
首先用废铝渣制取AI(OH)3固体,流程如下:
![]()
(1)调节pH用_________试剂为好。某同学在减压过滤时,布氏漏斗内没有得到产品,可能原因是______________________。
然后将氢氧化铝和甲醛依次加入到质量分数为50%的过氧化氢溶液中(投料物质的量之比依次为1∶3∶2),装置如图1.最终可得到含甲酸铝90%以上的优质产品。反应式为:2Al(OH)3+6HCHO+3H2O2=2Al(HCOO)3+6H2O+3H2↑。

(2)反应过程可看作两步进行,第一步______________(写出化学方程式),第二步为甲酸与Al(OH)3 反应生成甲酸铝。
(3)反应温度最好控制在30—70℃之间,温度不宜过高,主要原因是_________________。
(4)实验时需强力搅拌45 min,最后将溶液____________,抽滤,洗涤,干燥得产品。可用酸性KmnO4标准溶液滴定法来测定产品纯度,滴定起始和终点的滴定管液面位置见上图2, 则消耗的酸性KmnO4标准溶液体积为__________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对饱和AgCl溶液(有AgCl固体存在)进行下列操作后,c(Ag+)和Ksp(AgCl)均保持不变的是
A.加少量水稀释B.加热
C.加入少量盐酸D.加入少量AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机物分子式。

(1)A装置是提供实验所需的O2,则A装置中二氧化锰的作用是______,B装置中浓硫酸的作用是_______;C中CuO的作用是____________。
(2)D装置中无水氯化钙的作用是___________;E装置中碱石灰的作用是________。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44 g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88 g,已知该物质的相对分子质量为44,则该样品的化学式为_________。
(4)若该有机物的核磁共振氢谱如下图所示,峰面积之比为1:3则其结构简式为__________________;
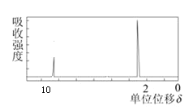
若符合下列条件,则该有机物的结构简式为_____________________ 。①环状化合物②只有一种类型的氢原子
(5)某同学认E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含有Mg2+,Ca2+,SO42-等离子,现进行粗盐的提纯,需将这些离子都除去,需要用到的试剂有如下几种:①BaCl2溶液②Na2CO3溶液③NaOH溶液④稀盐酸,则添加的正确顺序是
A.①②③④B.④①③②C.②③④①D.①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应4A(g)+5B(g)![]() 4C(g)+6D(g),取4 mol A和5 mol B置于容积为5 L的密闭容器中,20 s后,测得容器内A的浓度为0.4 mol·L-1。则此时B、C的浓度是多少?若以物质D来表示这段时间的反应速率应为多少?__________
4C(g)+6D(g),取4 mol A和5 mol B置于容积为5 L的密闭容器中,20 s后,测得容器内A的浓度为0.4 mol·L-1。则此时B、C的浓度是多少?若以物质D来表示这段时间的反应速率应为多少?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com