
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是___________________________________。
(3)③中所发生的各反应的离子方程式是___________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为__________,c(Fe2+)为__________。
答案 (1)加少量KClO3,插上镁条并将其点燃 Fe
(2)Fe2O3+6HCl===2FeCl3+3H2O、
MgO+2HCl===MgCl2+H2O
(3)Fe+2H+===Fe2++H2↑、Fe+2Fe3+===3Fe2+
(4)0.67 mol·L-1 2.3 mol·L-1
解析 此题将实验操作与元素化合物知识巧妙结合在一起考查,增大了试题的容量,增强了试题的测试能力。
(1)铝热反应是指单质Al和某些金属氧化物发生的反应,反应过程中放出大量热,但该反应需要较高的温度才能引发。在混合物上加少量KClO3固体并插上Mg条,点燃Mg条后放出热量,使KClO3固体分解放出O2,进一步加剧Mg的燃烧,可在短时间内使混合物温度迅速升高,引发反应。发生的反应为Fe2O3+2Al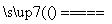 Al2O3+2Fe,所以产物中单质B为Fe。
Al2O3+2Fe,所以产物中单质B为Fe。
(2)Fe2O3和MgO都是碱性氧化物,能和酸反应生成盐和水:Fe2O3+6HCl===2FeCl3+3H2O、MgO+2HCl===MgCl2+H2O。
(3)混合物中只有Fe2O3能和Al发生铝热反应,生成Fe单质。C溶液中有反应生成的FeCl3,还有未反应的HCl。发生的离子反应为Fe+2H+===Fe2++H2↑、Fe+2Fe3+===3Fe2+。
(4)假设步骤②用去的20 g固体中,MgO的物质的量为x,则Fe2O3的物质的量也为x,则40 g·mol-1x+160 g·mol-1x=20 g,解得:x=0.1 mol。
根据MgO~MgCl2的关系,则溶液中MgCl2的浓度为
0.1 mol÷0.15 L=0.67 mol·L-1。
步骤④说明溶液中没有Fe3+,也就是溶质为FeCl2和MgCl2。根据Cl-不变的关系,可知MgCl2和FeCl2的总的物质的量等于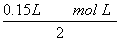 =0.45 mol,所以,FeCl2的浓度为
=0.45 mol,所以,FeCl2的浓度为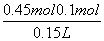 =2.3 mol·L-1。
=2.3 mol·L-1。


科目:高中化学 来源: 题型:
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
A.NaCl B.NH4Cl
C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+2H2O。若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
日光等白光经棱镜折射后产生的是________光谱。原子光谱则与之不同,它是由不连续特征谱线组成的,称为________光谱。
根据原子光谱谱线分析结果,可以得到的结论是原子轨道能量变化是不连续的,这种情况又称为原子的能量是________化的。
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法不正确的是( )
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是( )
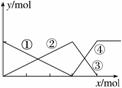
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示AlO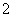 的物质的量的变化
的物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al
A.全部 B.只有①③④⑤
C.只有③④⑤ D.只有②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
有关碱金属的叙述正确的是( )
A.随核电荷数的增加,碱金属单质的熔点逐渐降低,密度逐渐增大
B.碱金属单质的金属性很强,均易与氯气、氧气、氮气等发生反应
C.碳酸铯加热时不能分解为二氧化碳和氧化铯
D.无水硫酸铯的化学式为Cs2SO4,它不易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com