
| 时间(mim) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(ML) | 50 | 120 | 232 | 290 | 310 |
分析 (3)在0~1、1~2、2~3、3~4、4~5min时间段中,相同时间内收集氢气的体积越多,说明反应速率越快,结合温度、浓度对反应速率的影响分析;
(4)计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=$\frac{△c}{△t}$计算反应速率;
(5)根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答 解:(3)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、58mL、20mL,相同时间内收集氢气的体积越多,说明反应速率越快,由此可知反应速率最大的时间段为2~3 min,反应速率最小的时间段是4~5min时间段,这是由于锌与盐酸是放热反应,温度升高,反应速率增大,随反应的进行H+浓度逐渐减小,反应速率减小,
故答案为:C;因反应为放热反应,温度升高,反应速率增大;
(4)在2~3min时间段内,n(H2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则υ(HCl)=$\frac{△c}{△t}$=$\frac{0.01mol}{0.1L×1min}$=0.1 mol/(L•min),
故答案为:0.1 mol/(L•min);
(5)A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;
B.加入NaCl溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;
C.加入NaNO3溶液,硝酸根离子在酸性条件下具有强氧化性,与锌反应生成NO气体,不生成氢气,故C错误;
D.加入CuSO4溶液,Zn置换出Cu,形成原电池加快反应速度,但不影响生成氢气的量,故D错误;
E.加入Na2CO3溶液,消耗H+,生成CO2气体,影响生成氢气的量,故E错误;
故答案为:AB.
点评 本题考查影响化学反应速率的因素,明确温度、浓度对反应速率的影响即可解答,最后一空为学生解答中的难点,注意硝酸的性质,题目难度不大.


科目:高中化学 来源: 题型:填空题
 ,取代反应
,取代反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
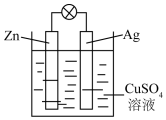 如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.
如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去热水瓶中的水垢 | |
| B. | 用米汤检验加碘盐中的碘酸钾(KIO3) | |
| C. | 向Al2(SO4)3溶液中加过量NaOH溶液,制Al(OH)3 | |
| D. | 向稀H2SO4催化水解后的麦芽糖溶液中直接加入新制Cu (OH)2悬浊液,检验水解产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
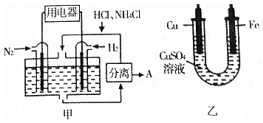 如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.
如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl-NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜.| A. | 通入H2-极与图乙中的铜电极相连 | |
| B. | 电池工作一段时间后,溶液pH减少1 | |
| C. | 当消耗0.025molN2时,则铁电极增重1.6g | |
| D. | 通入N2-端的电极反应式为:N2+8H++6e-═2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO | B. | MnO2 | C. | Fe2O3 | D. | Fe3O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com