
分析 根据n=$\frac{N}{{N}_{A}}$计算转移电子物质的量,转移电子即为Zn失去的电子,电极反应式为:Zn-2e-=Zn2+,根据转移电子计算Zn的物质的量,再根据m=nM计算消耗Zn的质量.
解答 解:转移电子物质的量为$\frac{3.01×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.05mol,则Zn失去电子为0.05mol,由电极反应式:Zn-2e-=Zn2+,可知消耗Zn的物质的量为0.05mol×$\frac{1}{2}$=0.025mol,则减少Zn的质量为0.025mol×65g/mol=1.625g,
故答案为:0.05;1.625.
点评 本题考查电化学有关计算,比较基础,注意电子转移守恒再电化学计算中应用,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、OH- | B. | Na+、NO3-、Cl- | ||
| C. | K+、H+、HCO3- | D. | Ca2+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、AlO2-、ClO- | ||
| C. | Fe2+、Na+、Cl-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径:F-<Mg2+<Al3+ | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
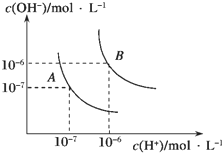
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
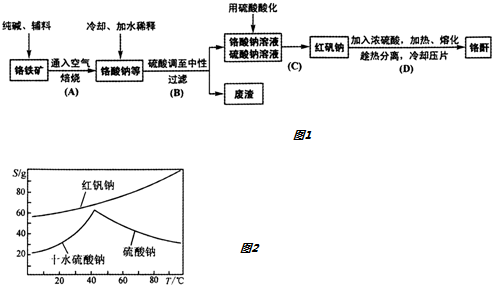
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com