
| 组别 | 温度/℃ | V(H2C2O4) /mL | V(KMnO4) /mL | V(H2O) /mL | KMnO4溶液 褪色时间/s |
| 1 | 30 | 10 | 10 | 20 | 40 |
| 2 | 30 | 20 | 20 | 0 | t |
| 3 | 30 | 15 | 10 | 15 |
分析 (1)草酸是二元弱酸,其分部电离;
(2)①此反应的反应物为酸性高锰酸钾和草酸溶液,生成物突然无色,说明生成锰离子,依据氧化还原反应原理书写化学反应方程式即可;
②根据浓度、温度、催化剂对化学反应速率的影响分析;
(3)①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,应使溶液总体积为40mL,高锰酸钾溶液体积不变,增大草酸溶液体积;
②实验2中,反应物浓度为实验1的2倍,但高锰酸钾浓度也增大为原来的2倍,不能确定反应的快慢.
解答 解:(1)草酸(H2C2O4)是一种二元弱酸,其分部电离,电离方程式为H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,
故答案为:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
(2)①酸性高锰酸钾和草酸溶液在硫酸酸化条件下生成硫酸锰、硫酸钾等,化学反应方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,
故答案为:2;5;6H+;2;10;8;
②随着反应的进行,反应物浓度逐渐减小,化学反应速率减慢,因此不是浓度,反应放热导致温度升高,化学反应速率加快,催化剂可以加快化学反应速率,应为Mn2+对该反应起催化作用,故答案为:C;
(3)①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,应使溶液总体积为40mL,高锰酸钾溶液体积不变,增大草酸溶液体积即可,可以是15mL草酸,10mL高锰酸钾,故答案为:15;10;
②实验2中,反应物浓度为实验1的2倍,但高锰酸钾浓度也增大为原来的2倍,不能确定反应的快慢,故答案为:D.
点评 本题考查了弱酸的电离方程式书写、氧化还原反应方程式书写以及影响化学反应速率因素的实验探究,题目难度较大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物必是共价化合物 | |
| B. | 阴、阳离子间通过静电引力所形成的化学键是离子键 | |
| C. | 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 | |
| D. | 液态氯化氢中存在H+和Cl-,所以能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫化钠中加入少量氯化铁S2-+2 Fe3+═2 Fe2++S↓ | |
| B. | 向Na2FeO4溶液中通入氧气和少量亚硫酸溶液10H++2 FeO42-+SO32-+O2═2Fe3++SO42-+5H2O | |
| C. | 用盐酸酸化的高锰酸钾溶液与过氧化氢反应,证明过氧化氢具有还原性:2 MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | 少量SO2通入苯酚钠溶液中2C6H5O-+SO2+H2O═C6H5OH+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )
如图所示其反应原理可以表示为4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2K2Cr2O7+4KOH+2H2↑+O2↑下列说法正确的是( )| A. | 随着反应进行,阴极PH逐渐减小 | |
| B. | OH-通过隔膜进入B池 | |
| C. | B池电极发生反应为2H2O+4e-4═H++O2↑ | |
| D. | 每转移2mol电子生成2g H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H14+9O2→CO+5CO2+7H2O | B. | C6H14+7O2→5CO+CO2+7H2O | ||
| C. | C6H14+8O2→3CO+3CO2+7H2O | D. | 2C6H14+15O2→8CO+4CO2+14H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
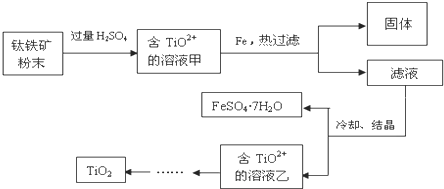
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V3>V2>V1 | B. | V1=V2=V3 | C. | V2>V1=V3 | D. | V1=V2<V3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com