
【题目】(1)写出下列物质的电子式:Na2O2____________; CO2______;HClO_________ 。
(2)画出下列各微粒的结构示意图:
①与Ne原子电子层结构相同的-2价阴离子的离子结构示意图_______________;
②质量数为23,中子数为12的原子的原子结构示意图______________。
【答案】![]()
![]()
![]() O2-
O2- 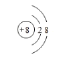
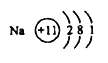
【解析】
(1)Na2O2是离子化合物,二氧化碳为共价化合物,HClO为共价化合物;
(2)①与Ne原子电子层结构相同的-2价阴离子是O2-;
②质量数为23,中子数为12的是Na原子。
(1)Na2O2是离子化合物,由Na+离子和O2-离子构成,电子式为![]() ;二氧化碳为共价化合物,分子中存在两对碳氧共用电子对,电子式为:
;二氧化碳为共价化合物,分子中存在两对碳氧共用电子对,电子式为:![]() ;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,电子式为:
;HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;![]() ;
;
(2)①与Ne原子电子层结构相同的-2价阴离子是O2-,O2-的离子结构示意图为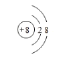 ,故答案为:
,故答案为: ;
;
②质量数为23,中子数为12的是Na原子,其质子数为11和电子数为11,原子结构示意图为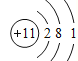 ,故答案为:
,故答案为: 。
。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】利用周期表中同主族元素的相似性,可预测元素的性质。
(1)白磷的分子式为P4,其结构如图甲所示。科学家目前合成了N4分子,N原子的杂化轨道类型是______;N4分解后能产生N2并释放出大量能量,推测其用途为____________。
(2)N、P、As原子的第一电离能由大到小的顺序为___________。
(3)比较酸性:HNO3_______HNO2(填“强于”或“弱于”),原因是___________________
(4)立方氮化硼晶体的结构如图乙所示。该晶体中,B原子填充在N原子的______(填空间构型名称)空隙中,且占据此类空隙的比例为________(填百分数)。


(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________;晶胞中K 原子的配位数为______;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 _______________(列出计算式,不需要计算出结果)。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的结构示意图为 ,由此得到的结论不正确的是
,由此得到的结论不正确的是
A. 该原子有3个电子层B. 该元素属于金属元素
C. 该原子在化学反应中易得2个电子D. 该元素的最高正化合价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对突如其来的新冠病毒,许多化学物质发挥了非常重要作用。下列说法正确的是
A.医用酒精灭活新冠肺炎病毒是利用其氧化性
B.N95 口罩所使用的聚丙烯材料属于合成纤维
C.为增强“84”消毒液的消毒效果,可滴加浓盐酸
D.我国研制的重组新冠疫苗无需冷藏保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色溶液中:Ca2+、Cu2+、Br-、Cl- 、
B. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、Cl-、I-
C. 能使酚酞变红的溶液中:K+、Na+、SiO32-、SO42-
D. ![]() =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 稀硝酸与Fe(OH)2溶液反应:Fe(OH)2+2H+= Fe2++2H2O
B. Cl2和水反应:Cl2+H2O=2H++Cl-+ClO-
C. 碳酸氢铵和足量的浓烧碱溶液混合:HCO3- +NH4++2OH-=NH3↑+2H2O+CO32-
D. SO2 与Ca(ClO)2溶液反应: SO2 +2ClO-+ Ca2+= CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中进行反应mX(g)+nY(g) ![]() qZ(g)ΔH>0,m+n<q达到平衡时,下列说法正确的是 ( )
qZ(g)ΔH>0,m+n<q达到平衡时,下列说法正确的是 ( )
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的逆反应速率是Y的正反应速率的n/m倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 增加X的物质的量,X的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O IO![]() →I2 MnO
→I2 MnO![]() →Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
→Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. H2O2 B. HNO2 C. MnO![]() D. IO
D. IO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.某粒子空间构型为平面三角形,则中心原子一定是sp2杂化
B.某粒子空间构型为V形,则中心原子一定有孤电子对
C.某粒子空间构型为三角锥形,则该粒子一定是极性分子
D.某粒子空间构型为正四面体,则键角一定是109°28′
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com