
| A、镁铝合金与盐酸反应时转移的电子数为0.3NA |
| B、x=2y |
| C、标况下共放出氢气2.24L |
| D、2x=y |
| 1.7g |
| 17g/mol |
| 0.1mol |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、2molNa被完全氧化生成1mol Na2O2,得到2NA个电子 |
| B、在1L0.1mol/L的碳酸钠溶液中,阴离子总数大于0.1NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
| D、在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol I2,则转移6NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组用电解CuSO4溶液的方法,测定铜的相对原子质量.(装置如图所示)
某化学兴趣小组用电解CuSO4溶液的方法,测定铜的相对原子质量.(装置如图所示)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解的实质是:阳极:2Cl--2e-=Cl2↑;阴极:Ag+e-=Ag |
| B、电解的实质是:阳极:4OH--4e-=2H2O+O2↑;阴极:2H++2e-=H2↑ |
| C、要恢复成电解前的溶液可以加水 |
| D、电解产物中氧化产物和还原产物的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
- 3 |
| A、10.6g | B、5.3g |
| C、21.6g | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
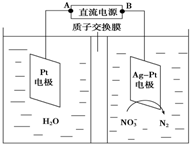 目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3- 或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )
目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3- 或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )| A、Pt电极为阴极 |
| B、电解过程中H+向正极移动 |
| C、理论上电解过程中阴、阳两极产生的气体在相同条件下体积比为2:5 |
| D、电解过程中Pt电极附近溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鉴别食盐和纯碱 |
| B、验证蛋壳的主要成分为CaCO3 |
| C、除去热水瓶内壁上的水垢 |
| D、检验自来水中是否含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com