
分析 (1)依据配制一定物质的量浓度溶液的一般步骤排序;
(2)依据配制溶液体积选择合适的容量瓶;
(3)依据m=CVM计算需要溶质氯化钠的质量;
(4)溶解时需要用玻璃棒搅拌,移液时需要用玻璃棒引流;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(6)溶液稀释过程中所含溶质的物质的量保持不变,据此计算需要浓溶液体积.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:①②④③⑤;
故答案为:①②④③⑤;
(2)需要480mL 0.4mol/L的NaCl溶液,应选择500mL容量瓶;
故答案为:500mL;
(3)配制500mL0.4mol/L的NaCl溶液,需要溶质的质量m=0.4mol/L×0.5L×58.5g/mol=11.7g;
故答案为:11.7;
(4)溶解时需要用玻璃棒搅拌,移液时需要用玻璃棒引流;
故答案为:①③;
(5)①依据左盘质量=右盘质量+游码质量,可知称量NaCl时,右物左码(1g以下用游码),实际称量质量为11-0.7g=10.3g,称取溶质的质量偏小,溶质的物质的量偏小,溶液浓度偏低;
②定容摇匀后溶液凹液面低于刻线,继续加水至凹液面与刻线相切,导致溶液体积偏大,溶液浓度偏低;
③移液时有少量溶液洒出容量瓶,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
故答案为:偏低;偏低;偏低;
(6)设需要浓溶液体积为V,溶液稀释过程中所含溶质的物质的量保持不变,则V×1.0mol/L=500mL×0.4mol/L,解得V=200.0mL;
故答案为:200.0.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格的选择及误差分析方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①④ | B. | 只有②③ | C. | ①②③ | D. | ①②③④都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-b+2 | B. | $\frac{N(a-b-2)}{a}$ | C. | $\frac{N(a-b+2)}{a}$ | D. | a-b-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式 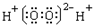 | |
| B. | 氨分子的结构式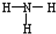 | |
| C. | S2-的结构示意图 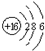 | |
| D. | 原子核内有20个中子的氯原子${\;}_{37}^{17}Cl$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com