
| 实验过程 | 预期现象 | 实际观察到的现象 |
| A用镊子从试剂瓶中取出一小块金属钠,用滤纸吸干表面的煤油后放入盛有水的烧杯中 | 立即剧烈反应 | 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b向盛有适量水(内含2滴 酚酞)的试管中加入一小段镁条 | 有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c向两支盛有3mL6mol?L-1盐酸的试管中加入大小相同的镁片和铝片 | 镁、铝与盐酸反应产生气泡剧烈程度不同 | 镁与盐酸反应产生气泡速率较快 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是一种新元素 |
| B、4526Fe与5626Fe互为同素异形体 |
| C、它是一种新核素 |
| D、这是铁原子发生衰变放出两个质子形成的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取7.68g硫酸铜,加入500mL水 |
| B、称取12.0g胆矾配成500mL溶液 |
| C、称取8.0g硫酸铜配成500mL溶液 |
| D、称取12.5g胆矾配成480mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg和Zn |
| B、Mg和Fe |
| C、A1和Na |
| D、A1和Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
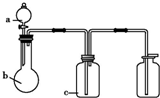 图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的
图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
| C | NO | 稀HNO3 | 铜屑 | H2O |
| D | Cl2 | 浓盐酸 | 高锰酸钾 | NaOH溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度溶液,定容时平视刻度线 |
| B、苯、四氯化碳、乙醇三种有机溶剂都可用来萃取溴水中的溴 |
| C、让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路” |
| D、配制100mL 1mol/L 的NaOH溶液,需称量4g 的氢氧化钠固体 |
| E、用铂丝蘸取少量溶液做焰色反应,没有观察到紫色,所以该溶液中不含钾元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com