
| A. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- | |
| B. | 中性溶液中:K+、Fe3+、Cl-、SO42- | |
| C. | AlO2一的浓度为0.1 mol/L的溶液中:K+、Na+、HCO3-、SO42- | |
| D. | Na2S溶液中:SO42-、K+、Cu2+、Cl- |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
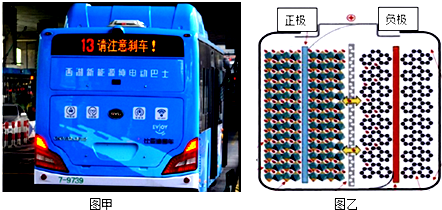
| A. | 充电时阳极反应可表示为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| B. | 充电时阴极反应可表示为xLi++xe-+6C=LixC6 | |
| C. | 放电时负极反应可表示为LixC6-xe-=xLi++6C | |
| D. | 放电时Li+从左向右通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC60F60分子中非极性共价键数目为60NA | |
| B. | 2.1gDTO分子中所含中子数为NA | |
| C. | 4.6gN2O4和NO2混合物中含的电子数为2.3NA | |
| D. | aml1mol/L的H2B溶液中,测得溶液中无H2B分子,则溶液中阴离子数为aNA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4在熔化状态下导电的本质原因是其中存在自由移动的离子 | |
| B. | 氯化银难溶于水,故其水溶液不导电 | |
| C. | 液态HCl中含有自由移动的Cl- | |
| D. | 电离是电解质在通电的作用下离解成自由移动的离子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c[NH3•H2O] | B. | c[H+] | C. | c[OH-] | D. | c[NH4+] |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
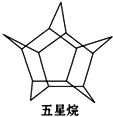 化学家合成了一种新物质-五星烷,它的分子立体结构如图所示:
化学家合成了一种新物质-五星烷,它的分子立体结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ka=$\frac{2×1{0}^{-7}}{0.1V-2}$ | B. | V=$\frac{2×1{0}^{-7}}{0.1{K}_{a}-2}$ | ||
| C. | Ka=$\frac{2×1{0}^{-7}}{V+20}$ | D. | Ka=$\frac{2×1{0}^{-8}}{V}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com