
【题目】(1)按如图所示操作,充分反应后:
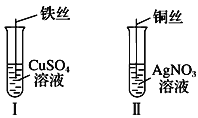
①Ⅰ中发生反应的离子方程式为______________;
②Ⅱ中铜丝上观察到的现象是_____________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为________。
(2)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是__,被氧化的元素是____,氧化剂是____,还原剂是__,氧化产物是____,还原产物是_____。
(3)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中氧化产物是_____;若反应中转移了0.3 mol电子,则还原产物的质量是____g。
【答案】Fe+Cu2+=Fe2++Cu 红色铜丝上有银白色金属附着 Ag+>Cu2+>Fe2+ N、S C KNO3、S C CO2 N2、K2S S 3
【解析】
(1)①发生Fe与硫酸铜的置换反应生成Cu和硫酸亚铁,离子反应为Fe+Cu2+=Fe2++Cu,
故答案为:Fe+Cu2+=Fe2++Cu;
②发生Cu与硝酸银的置换反应,该反应为Cu+2AgNO3═Cu (NO3)2+2Ag,观察到红色铜丝上有白色金属Ag附着,
故答案为:红色铜丝上有白色金属Ag附着;
③由两个反应可知,得到电子的为氧化剂,还有剂对应的产物为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,由Fe+Cu2+=Fe2++Cu可知,氧化性Cu2+>Fe2+;Cu+2AgNO3═Cu(NO3)2+2Ag可知,氧化性Ag+>Cu2+,则氧化性为Ag+>Cu2+>Fe2+,
故答案为:Ag+>Cu2+>Fe2+;
(2)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,该反应中S元素化合价由0价变为2价、N元素化合价由+5价变为0价、C元素化合价由0价变为+4价,其中被还原的元素是N、S,被氧化的元素是C,氧化剂是KNO3、S,还原剂是C,氧化产物是CO2,还原产物是N2、K2S;
故答案为:N、S;C;KNO3,S;C;CO2;N2、K2S;
(3)HNO3有强氧化性,H2S具有较强还原性,二者反应氧化还原反应,故NO为还原产物、S为氧化产物,若反应过程中转移了0.3mol电子,由电子转移守恒,可知生成NO的物质的量为:![]() =0.1mol,故生成S的质量为:0.1mol×30g/mol=3g,
=0.1mol,故生成S的质量为:0.1mol×30g/mol=3g,
故答案为:S;3。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注。利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理。
Ⅰ.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O![]() ,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。
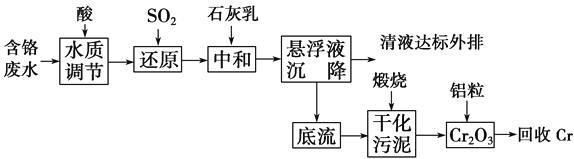
(1)请写出通入SO2时发生的离子反应:______________________________________。
(2)写出加入铝粒时发生反应的化学方程式____________________________________。
Ⅱ.铬渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成分。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其他成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
碱性溶液还原法:直接在碱性铬渣中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。
(3)铬渣烧结炼铁法中煤粉的作用是____________。(写两点)
(4)请配平碱性溶液还原法中发生的离子反应:_______________
![]() Cr2O72-+
Cr2O72-+![]() S2-+
S2-+![]() H2O===
H2O===![]() Cr(OH)3↓+
Cr(OH)3↓+![]() S2O32-+
S2O32-+![]() OH-
OH-
(5)用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物可能是________(填序号);
①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4
在这些混合物中,各成分的物质的量之比是________。
Ⅲ.电解法处理
工业上处理含Cr2O72-离子的酸性废水,采用以下处理方法。①往工业废水中加入适量的食盐(1~2 g·L-1),搅拌均匀;②用Fe为电极进行电解;③鼓入空气,经过一段时间后,使废水中的含铬(有毒)量降到可排放的标准。其原理是:①将Cr2O![]() 离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
离子还原为可溶性三价铬离子;②要在电解除铬过程中,使溶液的pH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变为不溶性氢氧化物除去。
(6)加入食盐的目的是______________________________________________________;电解时阳极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.将1L0.1mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为0.1NA
B.常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子
C.1L0.1mol/L Na2SO4溶液中含有0.4NA个氧原子
D.在标准状况下,22.4L的CCl4所含的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯中盛有100 mL1mol/L的NaHSO4溶液,向其中逐滴滴加1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )
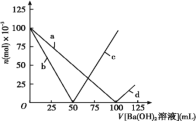
A.曲线d表示Na+的物质的量的变化
B.曲线c表示OH-的物质的量的变化
C.加入Ba(OH)2溶液50 mL反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法中正确的是( )
A.夏日的傍晚常常看到万丈霞光穿云而过,美不胜收,这与胶体性质有关
B.浊液、胶体和溶液的最根本的区别是能否发生丁达尔效应
C.采用过滤法,可将![]() 胶体中的
胶体中的![]() 杂质除去
杂质除去
D.向三氯化铁溶液中滴入氢氧化钠溶液可制得![]() 胶体
胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在能源开发与利用中起着十分关键的作用。能源分为一级能源和二级能源,将自然界中存在的能源称为一级能源,通过其它方式获得的能源称为二级能源。甲烷、氢气是重要的能源。回答下列问题:
(1)关于甲烷、氢气的说法正确的是___
A.甲烷和氢气都是一级能源 B.甲烷是一级能源,氢气是二级能源
C.甲烷和氢气都是二级能源 D.甲烷是二级能源,氢气是一级能源
(2)![]() 经催化重整可以获得合成气:
经催化重整可以获得合成气:![]()
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H |
| H—H |
|
键能/ | 413 | 745 | 436 | 1075 |
则该反应的![]() _____
_____![]() 。
。
②已知:![]()
![]()
![]()
![]()
而C(s)的燃烧热![]()
该催化重整反应的![]() ___
___![]() (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(3)氢气是氯碱工业的副产品,产生氢气的电极反应式为___。
(4)利用氢气可以合成氨,将![]() 通入NaClO的溶液中可以获得
通入NaClO的溶液中可以获得![]() 写出
写出![]() 的电子式__。该反应的化学方程式为____。
的电子式__。该反应的化学方程式为____。
(5)CO也是一种重要燃料,利用其燃烧可以设计成新型燃料电池,该电池利用熔融的碳酸盐为电解质,该燃料电池负极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
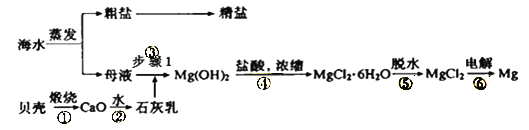
I.(1)上述过程中没有涉及到的四大基本反应类型是___;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤③中分离操作的名称是___;
II.实验室需要480mL2.0mol·L-1NaCl溶液。
(3)除烧杯和玻璃棒、胶头滴管外,还需要的玻璃仪器有___;
(4)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是___;
(5)下列错误操作可使所配制氯化钠溶液浓度偏低的是___。
a.容量瓶洗净后残留了部分的水 b.转移时溶液溅到容 量瓶外面
c.定容时俯视容量瓶的刻度线 d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有21.6g由CO和CO2组成的混合气体,在标准状况下其体积为13.44L。回答下列问题:
(1)该混合气体CO和CO2的物质的量之比为___,平均摩尔质量为___。
(2)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
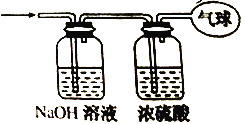
①气球中收集到的气体的摩尔质量为___。
②气球中收集到的气体中,电子总数为___NA。
③气球的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
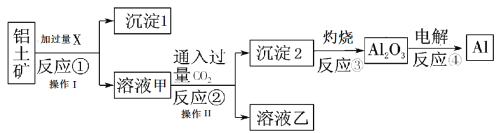
试回答下列问题:
(1)试剂X为_________;反应①的化学方程式为_______________。
(2)操作I 、操作II均为_______(填操作名称)。反应①②③④中属于氧化还原反应的是________(填数字序号)。
(3)反应②的化学方程式为_________________。
(4)金属铝与氧化铁的混合物在高温下会发生剧烈的反应,该反应的化学方程式为___
(5)反应④制取金属铝,若有0.6mol电子发生发生转移,理论上能得到金属铝的质量是________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com