
| A. | 用石墨作电极电解AlC13溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++4 O2↑+6H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br -+2NO3-+8H+═3Br2+2NO↑+4H2O |
分析 A.用石墨作电极电解AlC13溶液生成氢氧化铝、氢气、氯气;
B.得失电子不守恒;
C.向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀,二者物质的量之比为1:1;
D.二价铁离子还原性强于溴离子,先养好二价铁离子.
解答 解:A.用石墨作电极电解AlC13溶液生成氢氧化铝、氢气、氯气,离子方程式:2Al3++6Cl-+6H2O$\frac{\underline{\;通电\;}}{\;}$3Cl2↑+3H2↑+Al(OH)3↓,故A错误;
B.酸性高锰酸钾溶液与H2O2溶液混合,离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,故B错误;
C.向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀,二者物质的量之比为1:1,离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O,故C正确;
D.亚铁离子的还原性大于溴离子,向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸离子方程式为Fe2++Br-+4H++NO3-═Br2+NO↑+2H2O+Fe3+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,涉及氧化还原反应,明确离子反应先后顺序、反应实质是解本题关键,再结合原子守恒、电荷守恒、转移电子守恒等知识点来分析解答,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
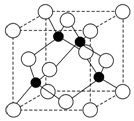 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ②③⑥⑦ | C. | ①③⑥⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
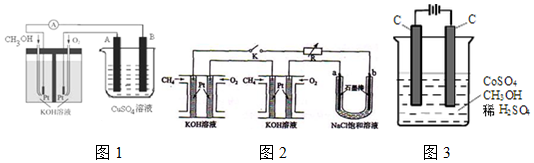
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
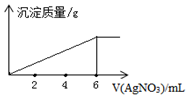
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com