
 Ō×ÓŠņŹżŅĄ“ĪŌö¼ÓµÄX”¢Y”¢Z”¢WĖÄÖÖŌŖĖŲŌ×ÓŠņŹż¾łŠ”ÓŚ36£¬Y»łĢ¬Ō×Ó×īĶā²ćµē×ÓŹżŹĒĘäÄŚ²ćµē×Ó×ÜŹżµÄ3±¶£¬X”¢W»łĢ¬Ō×ÓŹĒĶ¬ÖÜĘŚŌŖĖŲÖŠĪ“³É¶Ōµē×ÓŹż×ī¶ąµÄŌ×Ó£¬XÓėZµÄŌ×ÓŗĖÄŚÖŹ×ÓŹżÖ®ŗĶµČÓŚWŌ×ÓŗĖÄŚÖŹ×ÓŹż£¬Z»łĢ¬Ō×ÓÖ»ÓŠ1øöĪ“³É¶ŌµÄµē×Ó£®
Ō×ÓŠņŹżŅĄ“ĪŌö¼ÓµÄX”¢Y”¢Z”¢WĖÄÖÖŌŖĖŲŌ×ÓŠņŹż¾łŠ”ÓŚ36£¬Y»łĢ¬Ō×Ó×īĶā²ćµē×ÓŹżŹĒĘäÄŚ²ćµē×Ó×ÜŹżµÄ3±¶£¬X”¢W»łĢ¬Ō×ÓŹĒĶ¬ÖÜĘŚŌŖĖŲÖŠĪ“³É¶Ōµē×ÓŹż×ī¶ąµÄŌ×Ó£¬XÓėZµÄŌ×ÓŗĖÄŚÖŹ×ÓŹżÖ®ŗĶµČÓŚWŌ×ÓŗĖÄŚÖŹ×ÓŹż£¬Z»łĢ¬Ō×ÓÖ»ÓŠ1øöĪ“³É¶ŌµÄµē×Ó£® £®
£®·ÖĪö Ō×ÓŠņŹżŅĄ“ĪŌö¼ÓµÄX”¢Y”¢Z”¢WĖÄÖÖŌŖĖŲŌ×ÓŠņŹż¾łŠ”ÓŚ36£¬Y»łĢ¬Ō×Ó×īĶā²ćµē×ÓŹżŹĒĘäÄŚ²ćµē×Ó×ÜŹżµÄ3±¶£¬Ō×ÓÖ»ÄÜÓŠ2øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ŌņYĪŖOŌŖĖŲ£»X”¢W»łĢ¬Ō×ÓŹĒĶ¬ÖÜĘŚŌŖĖŲÖŠĪ“³É¶Ōµē×ÓŹż×ī¶ąµÄŌ×Ó£¬XŌ×ÓŠņŹż±ČŃõŠ”£¬ŌņXŌŚµŚ¶žÖÜĘŚ£¬ĶāĪ§µē×ÓÅŲ¼ĪŖ2s22p3£¬¹ŹXĪŖNŌŖĖŲ£¬ŌņWĪŖµŚČżÖÜĘŚµÄP»ņµŚĖÄÖÜĘŚµÄCr£¬ÓÉÓŚXÓėZµÄŌ×ÓŗĖÄŚÖŹ×ÓŹżÖ®ŗĶµČÓŚWŌ×ÓŗĖÄŚÖŹ×ÓŹż£¬ČōWĪŖP£¬ŌņZĪŖO£¬ÓėYĻąĶ¬£¬ĖłŅŌ²»·ūŗĻĢāŅā£¬ČōWĪŖCr£¬ŌņZĪŖCl£¬¶ųĒŅClµÄ»łĢ¬Ō×ÓÖ»ÓŠ1øöĪ“³É¶ŌµÄµē×Ó£¬·ūŗĻĢāŅā£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗŌ×ÓŠņŹżŅĄ“ĪŌö¼ÓµÄX”¢Y”¢Z”¢WĖÄÖÖŌŖĖŲŌ×ÓŠņŹż¾łŠ”ÓŚ36£¬Y»łĢ¬Ō×Ó×īĶā²ćµē×ÓŹżŹĒĘäÄŚ²ćµē×Ó×ÜŹżµÄ3±¶£¬Ō×ÓÖ»ÄÜÓŠ2øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ŌņYĪŖOŌŖĖŲ£»X”¢W»łĢ¬Ō×ÓŹĒĶ¬ÖÜĘŚŌŖĖŲÖŠĪ“³É¶Ōµē×ÓŹż×ī¶ąµÄŌ×Ó£¬XŌ×ÓŠņŹż±ČŃõŠ”£¬ŌņXŌŚµŚ¶žÖÜĘŚ£¬ĶāĪ§µē×ÓÅŲ¼ĪŖ2s22p3£¬¹ŹXĪŖNŌŖĖŲ£¬ŌņWĪŖµŚČżÖÜĘŚµÄP»ņµŚĖÄÖÜĘŚµÄCr£¬ÓÉÓŚXÓėZµÄŌ×ÓŗĖÄŚÖŹ×ÓŹżÖ®ŗĶµČÓŚWŌ×ÓŗĖÄŚÖŹ×ÓŹż£¬ČōWĪŖP£¬ŌņZĪŖO£¬ÓėYĻąĶ¬£¬ĖłŅŌ²»·ūŗĻĢāŅā£¬ČōWĪŖCr£¬ŌņZĪŖCl£¬¶ųĒŅClµÄ»łĢ¬Ō×ÓÖ»ÓŠ1øöĪ“³É¶ŌµÄµē×Ó£¬·ūŗĻĢāŅā£®
£Ø1£©ŅŃÖŖ»ÆŗĻĪļNCl 3ÓėH2O·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖNCl 3+H2O”śNH3+HClO£¬·“Ó¦²śĪļHClOÖŠOŌŖĖŲĪŖ-2¼Ū£¬ClŌŖĖŲĪŖ+1¼Ū£¬¼“OµÄµĆµē×ÓÄÜĮ¦øüĒ棬ĖłŅŌµēøŗŠŌO“óÓŚCl£¬HClOµÄµē×ÓŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ“óÓŚ£» £»
£»
£Ø2£©NŌŖĖŲµÄŅ»ÖÖĒā»ÆĪļµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ32£¬øĆĒā»ÆĪļŹĒN2H4£¬Ęä½į¹¹Ź½ĪŖ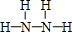 £¬·Ö×ÓÖŠŗ¬ÓŠ5øö¦Ņ¼ü£¬ĖłŅŌ1moløĆĒā»ÆĪļÖŠµÄ¦Ņ¼üŹżŹĒ5NA£»
£¬·Ö×ÓÖŠŗ¬ÓŠ5øö¦Ņ¼ü£¬ĖłŅŌ1moløĆĒā»ÆĪļÖŠµÄ¦Ņ¼üŹżŹĒ5NA£»
¹Ź“š°øĪŖ£ŗ5NA£»
£Ø3£©WĪŖCrŌŖĖŲ£¬Ō×ÓŗĖĶāÓŠ24øöµē×Ó£¬ĖłŅŌ»łĢ¬Ō×ӵĵē×ÓÅŲ¼Ź½ŹĒ£ŗ1s22s22p63s23p63d54s1£¬ÓÉĶ¼æÉÖŖ£¬¾§°ūÄŚ²æŗ¬ÓŠ4øöøõĄė×Ó£¬O2-ŹżÄæĪŖ£ŗ$\frac{1}{2}$”Į2+$\frac{1}{6}$”Į12+3=6£¬ŌņøõĄė×ÓÓėO2-Ąė×ÓŹżÖ®±ČĪŖ2£ŗ3£¬ĖłŅŌøĆ¾§ĢåµÄ»ÆѧŹ½ĪŖCr2O3£»
¹Ź“š°øĪŖ£ŗ1s22s22p63s23p63d54s1£»Cr2O3£»
£Ø4£©ÓÉĶ¼æÉÖŖ£¬øĆ¾§°ūĪŖĮł·½×īĆܶѻż£¬ÓėMg¾§ĢåµÄ¶Ń»ż·½Ź½ĻąĶ¬£»
¹Ź“š°øĪŖ£ŗĆ¾£®
µćĘĄ ±¾ĢāŹĒ¶ŌĪļÖŹ½į¹¹µÄ漲飬Éę¼°ŗĖĶāµē×ÓÅŲ¼”¢µē×ÓŹ½”¢µēøŗŠŌ”¢»Æѧ¼ü”¢¾§°ū½į¹¹Óė¼ĘĖćµČ£¬×¢ŅāŹ¶¼Ē֊ѧ³£¼ū¾§°ū½į¹¹Óė½šŹō¶Ń»ż·½Ź½£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘĻĢŃĢĒ”¢ÕįĢĒ”¢ÓĶÖ¬ŗĶµ°°×ÖŹŌŚŅ»¶ØĢõ¼žĻĀ¶¼ÄÜĖ®½ā | |
| B£® | µČÖŹĮæµÄ¼×Ķ锢ŅŅĻ©”¢1£¬3-¶”¶žĻ©£ØC4H6£©·Ö±šŌŚæÕĘųÖŠ³ä·ÖČ¼ÉÕ£¬ĖłŗÄÓĆŃõĘųµÄĮæŅĄ“ĪŌö“ó | |
| C£® | ²»ÓĆČĪŗĪŹŌ¼ĮŗĶŅĒĘ÷æɼų±šŅŅ“¼”¢ŅŅĖį”¢ŅŅĖįŅŅõ„”¢±½ĖÄÖÖÓŠ»śĪļ | |
| D£® | Čō¼×ĶéÓėĀČĘųŅŌĪļÖŹµÄĮæÖ®±Č1£ŗ3»ģŗĻ£¬ŌŚ¹āÕÕĻĀµĆµ½µÄ²śĪļÖ»ÓŠCHCl3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 50mL 0.5mol/LµÄŃĪĖįÓė50mL0.55mol/LµÄNaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮææɼĘĖć·“Ó¦ČČ£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
50mL 0.5mol/LµÄŃĪĖįÓė50mL0.55mol/LµÄNaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮææɼĘĖć·“Ó¦ČČ£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 8øöÖŠ×ÓµÄĢ¼Ō×Ó£ŗ12C | B£® | HClOµÄ½į¹¹Ź½£ŗH-Cl-O | ||
| C£® | Ć¾Ąė×ӵĽį¹¹Ź¾ŅāĶ¼£ŗ | D£® | 15NµÄµē×ÓÅŲ¼Ź½£ŗ1s22s22p4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | N2H4£Øg£©+2H2O2£Øl£©=N2£Øg£©+4H2O£Øl£©”÷H=+817.63 kJ•mol-1 | |
| B£® | N2H4£Øg£©+2H2O2£Øl£©=N2£Øg£©+4H2O£Øg£©”÷H=-641.63 kJ•mol-1 | |
| C£® | N2H4£Øg£©+2H2O2£Øl£©=N2£Øg£©+4H2O£Øl£©”÷H=-641.63 kJ•mol-1 | |
| D£® | N2H4£Øg£©+2H2O2£Øl£©=N2£Øg£©+4H2O£Øg£©”÷H=-817.63 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹żĮæCO2ĶØČėĘ«ĀĮĖįÄĘČÜŅŗÖŠ£ŗ2AlO2-+CO2+3H2OØT2Al£ØOH£©3”ż+CO32- | |
| B£® | Ļņ“ĪĀČĖįÄĘČÜŅŗÖŠĶØČė×ćĮæSO2ĘųĢå£ŗClO-+SO2+H2OØTHClO+HSO${\;}_{3}^{-}$ | |
| C£® | ĖįŠŌĢõ¼žĻĀĖ«ŃõĖ®ŗĶKIČÜŅŗ·“Ó¦£ŗ2I-+H2O2+2H+ØTI2+2H2O | |
| D£® | Ģ¼ĖįĒāļ§ČÜŅŗÓė×ćĮæµÄKOHČÜŅŗ»ģŗĻŗó¼ÓČČ£ŗNH4++OH-$\frac{\underline{\;\;”÷\;\;}}{\;}$NH3”ü+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ĻÖÓŠĻĀĮŠ»ÆѧŹŌ¼Į£ŗ
ĻÖÓŠĻĀĮŠ»ÆѧŹŌ¼Į£ŗ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com