
| A、为实现铁上镀铜,可把铁作为阳极 |
| B、氯碱工业通过电解熔融的NaCl生产Cl2 |
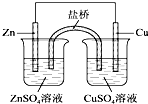
| C、如图所示,盐桥中的K+移向ZnSO4溶液 |
| D、氢氧燃料电池(碱性电解质溶液)中O2通入正极,电极反应为O2+2H2O+4e-═4OH- |


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、80gNH4NO3 中含有氮原子数为2NA |
| B、1Llmol?L-1盐酸中含有氯化氢分子数为NA |
| C、标准状况下,11.2LCCl4 所含分子数为0.5NA |
| D、铁在氯气中燃烧,1lmolFe失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2的结构式:H-O-H-O |
B、硫离子的结构示意图: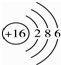 |
C、二氧化碳的比例模型: |
| D、氧化铁的化学式:FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性:Na>Mg>Al |
| B、原子半径:Na>S>O |
| C、碱性:KOH>NaOH>LiOH |
| D、酸性:HIO4>HBrO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com