
| A. | Mg和Al都可以用电解法冶炼得到 | |
| B. | Mg和Fe在一定条件下与水反应都生成H2 和对应的碱 | |
| C. | Fe和Cu常温下放入浓硝酸中发生的现象相同 | |
| D. | Na2O和Na2O2与CO2反应产物也相同 |
分析 A.Mg和Al都为活泼金属,应用电解法冶炼;
B.铁和水蒸气在高温下反应生成四氧化三铁;
C.Cu常温下与浓硝酸反应,Fe常温下在浓硝酸中钝化;
D.Na2O和CO2反应生成碳酸钠,Na2O2与CO2反应生成碳酸钠和氧气.
解答 解:A.常见金属的冶炼方法有电解法、热还原法、热分解法等,其中Mg和Al都为活泼金属,应用电解法冶炼,故A正确;
B.铁和水蒸气在高温下反应生成四氧化三铁,不生成碱,故B错误;
C.Cu常温下与浓硝酸反应生成二氧化氮,Fe常温下在浓硝酸中钝化,故C错误;
D.Na2O和CO2反应生成碳酸钠,Na2O2与CO2反应除生成碳酸钠外,还有氧气,故D错误.
故选:A.
点评 本题考查较为综合,涉及钠、镁、铝、铁等金属单质及其化合物的性质,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,为高频考点,注相关基础知识的积累,难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 10.80 | 30.70 |
| 第二次 | 25.00 | 14.20 | 34.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
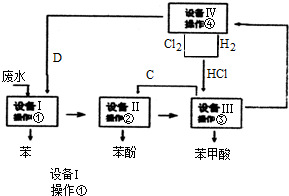
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H12O6(葡萄糖)+6O2═6CO2+6H2O | B. | CH3COOH+KOH═CH3COOK+H2O | ||
| C. | 所有高温条件下发生的反应 | D. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
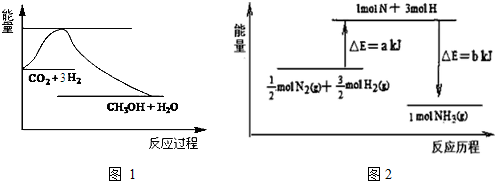
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
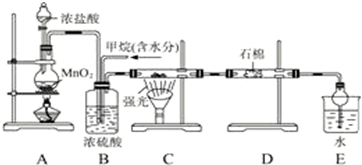
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com