
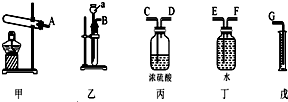
分析 要测定合金中Zn的质量分数,应该用合金和稀盐酸或稀硫酸反应生成氢气,然后利用排水法收集气体,排除水的体积等于收集气体体积,再利用氢气与锌之间的关系式计算锌的质量,从而确定其质量分数;
(1)该仪器名称是长颈漏斗;
(2)根据实验目的及各个仪器用途确定选取仪器;气体收集时采用排水法收集,则导气管应该采用“短进长出”原则,根据制取气体、收集气体、排除液体顺序排列装置;
(3)集气瓶的磨砂部分位于瓶口边缘;
(4)有连接的装置实验前都必须检验装置气密性;
(5)锌和稀盐酸反应生成氯化锌和氢气;根据锌和氢气之间的关系式计算锌的质量,从而计算其质量分数.
解答 解:要测定合金中Zn的质量分数,应该用合金和稀盐酸或稀硫酸反应生成氢气,然后利用排水法收集气体,排除水的体积等于收集气体体积,再利用氢气与锌之间的关系式计算锌的质量,从而确定其质量分数;
(1)该仪器名称是长颈漏斗,故答案为:长颈漏斗;
(2)实验顺序是制取气体、收集气体、测量排出水的体积,所以应该选取装置为乙丁戊;气体收集时采用排水法收集,则导气管应该采用“短进长出”原则,根据制取气体、收集气体、排除液体顺序排列装置,所以若产生的气体从左向右流,则接口的顺序为,故答案为:乙丁戊;B F E G;
(3)集气瓶的磨砂部分位于瓶口边缘,这样集气瓶口和玻璃片能紧密结合,防止生成的气体逸出,故答案为:b;
(4)有连接的装置实验前都必须检验装置气密性,所以该装置中实验前要检验装置气密性,故答案为:检验装置气密性;
(5)锌和稀盐酸反应生成氯化锌和氢气,反应方程式为Zn+2HCl=ZnCl2+H2↑;氢气物质的量=$\frac{0.09g/L×1.1L}{2g/mol}$=0.0495mol,根据锌和氢气关系式知,二者物质的量相等,所以锌的质量=0.0495mol×65g/mol=3.2175g,其质量分数=$\frac{3.2175g}{9.9g}$×100%=32.5%,
故答案为:Zn+2HCl=ZnCl2+H2↑;32.5%.
点评 本题考查物质含量测定,为高频考点,侧重考查学生实验操作、实验分析、计算能力,综合性较强,明确实验目的、实验操作步骤等是解本题关键,难点是实验装置顺序排列,题目难度不大.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3Na与O2完全反应生成3.6g产物时失去电子数为0.1NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 标准状况下,11.2LSO3中所含原子数为2NA | |
| D. | 5.6g铁粉与稀硝酸反应失去的电子数一定为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是| A | B | C | D | |
| a电极 | 阳极 | 阴极 | 阳极 | 阴极 |
| d电极 | 正极 | 正极 | 负极 | 负极 |
| Q离子 | 阳离子 | 阳离子 | 阴离子 | 阴离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
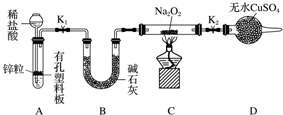 Na2O2可用作漂白剂和呼吸面具中的供氧剂.
Na2O2可用作漂白剂和呼吸面具中的供氧剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者阴阳离子个数之比都为2:1 | |
| B. | 二者都能与CO2发生化合反应生成Na2CO3 | |
| C. | 二者都是强氧化剂 | |
| D. | 1molNa2O2与足量盐酸反应,转移电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  热化学方程式是H2(g)+$\frac{1}{2}$O2(g)=H2O(g) DH=-241.8 kJ/mol | |
| B. | 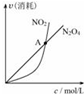 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 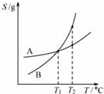 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. |  HA的酸性强于HB |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com