
| A. | 常温常压下,21g氧气和27g臭氧所含氧原子总数为3NA | |
| B. | 34gH2O2中含阴离子数为NA | |
| C. | 饱和FeCl3溶液加入沸水中,若有1molFeCl3水解,可生成NA个胶体粒子 | |
| D. | 80mL10mol/L浓盐酸与足量MnO2加热反应,转移电子数为0.4NA |
分析 A、氧气和臭氧均有氧原子构成;
B、H2O2是共价化合物,不含阴离子;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、二氧化锰只能与浓盐酸反应,一旦溶液变稀,反应即停止.
解答 解:A、氧气和臭氧均有氧原子构成,故21g氧气和27g臭氧的混合物中,无论两者所占的质量分别为多少,只要混合物为(21+27)g=48g,含有的氧原子的物质的量n=$\frac{48g}{16g/mol}$=3mol,个数为3NA个,故A正确;
B、H2O2是共价化合物,在熔融状态下不能电离出阴离子,故B错误;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故将1mol1molFeCl3水解,所得到的氢氧化铁胶粒的个数小于NA个,故C错误;
D、80mL10mol/L浓盐酸的物质的量n=CV=10mol/L×0.08L=0.8mol,但二氧化锰只能与浓盐酸反应,一旦溶液变稀,反应即停止,故0.8mol盐酸不能完全反应,则转移的电子的物质的量小于0.4mol,即小于0.4NA个,故D错误.
故选A.
点评 本题考查了物质的量以及阿伏伽德罗常数的有关计算,熟练掌握公式的使用以及物质的结构特点是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 序号 | 实验目的 | 实验方法 |
| ① | 检验混合气体N2和NH3中有NH3 | |
| ② | 除去NaCl和NH4Cl固体混合物中的杂质NH4Cl | |
| ③ | 观察铜与浓硫酸在试管中共热后产物溶液的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性 F->Cl->Br- | B. | 碱性:Na(OH)2>Mg(OH)2>Al(OH)3 | ||
| C. | 酸性 HClO4>HBrO4>HIO4 | D. | 稳定性 HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
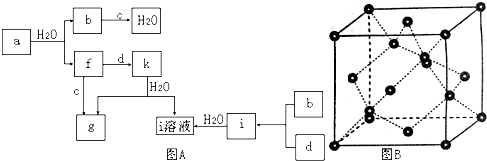
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下80gSO2与33.6LCO2含氧原子数目均为3NA | |
| B. | 2molNO与1molO2混合后气体分子数小于2NA | |
| C. | 电解精炼铜时,阳极上粗铜质量减少6.4g,则电路中转化电子数为0.2NA | |
| D. | 1molCnH2n(烯烃)含有的共用电子对数为3nNA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
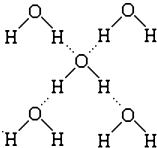 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.根据下列信息回答问题:
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.根据下列信息回答问题: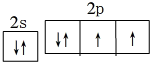
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a极为铜,b极为锌 | |
| B. | A池中盛放的是CuSO4溶液,B池中盛放的是ZnSO4溶液 | |
| C. | 当正极质量增加64g时,负极质量减小65g | |
| D. | 盐桥中的阳离子向锌极移动,阴离子向铜极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com