
【题目】下列说法正确的( )
A.复分解反应可能是氧化还原反应B.置换反应一定是氧化还原反应
C.化合反应不是氧化还原反应D.氧化还原反应中一定有氧元素参加
科目:高中化学 来源: 题型:
【题目】保护环境、保护地球已成为人类共同的呼声。下列措施不利于环境保护的是( )
A.推广使用无铅汽油
B.提倡使用太阳能
C.推广使用无磷洗衣粉
D.提倡个人使用大批量汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化硫与一氧化碳能迅速发生如下反应:SO2+2CO![]() S+2CO2。某同学利用如下图所示装置探究上述反应生成的气态产物,部分夹持仪器未画出。
S+2CO2。某同学利用如下图所示装置探究上述反应生成的气态产物,部分夹持仪器未画出。
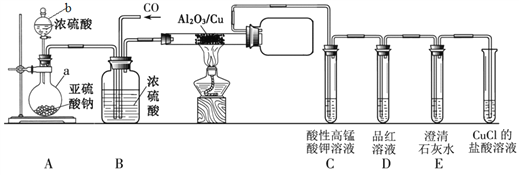
查阅资料知:CO不能被酸性高锰酸钾溶液氧化,CuCl的盐酸溶液能吸收CO。回答下列问题:
(1)仪器a的名称是_____________。装置A中发生的反应是否属于氧化还原反应:________(填“是” 、“否”)。
(2)装置B中浓硫酸表现出的性质是________________。
(3)亚硫酸钠暴露在空气中易变质,其反应的化学方程式为___________。
(4)装置C、D、E用来除去未反应的SO2并检验反应生成的CO2。
①装置D中品红溶液的作用是______________________________。
②配平装置C中反应的离子方程式:_____
SO2 + MnO4ˉ + H2O — SO42ˉ + Mn2+ + H+
③下列溶液中,不能替换酸性高锰酸钾溶液的是_________(填字母标号)。
A.溴水 B.饱和NaHCO3溶液 C.Na2SO3溶液
D. Fe2(SO4)3溶液 E.Na2CO3溶液
④有同学认为,省略去装置D,也能达到同样的实验目的。此时装置C中观察到的现象______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾是放错了位置的资源。如废弃的热塑性塑料可通过清洗、熔融,重新制成塑料。塑料属于( )
A.无机非金属材料
B.有机合成材料
C.复合材料
D.合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是两种生物干重中有关元素的质量分数(%)。根据下表,有人得出下面结论,其中正确的是( )
元素 | C | H | O | N | P | S |
生物甲 | 43.57 | 6.24 | 44.43 | 1.46 | 0.20 | 0.17 |
生物乙 | 55.99 | 7.46 | 14.62 | 9.33 | 3.11 | 0.78 |
A.如果它们分别是动物和植物,则甲是动物,乙是植物
B.甲生物可能含有叶绿素
C.两者体细胞中,甲有细胞核乙没有细胞核
D.两者的含水量比较,可推测甲比乙多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2之间存在反应:N2O4(g)![]() 2NO2 (g) ΔH=+57.2 kJ/mol。
2NO2 (g) ΔH=+57.2 kJ/mol。
(1)将一定量N2O4加入到恒温恒容的密闭容器中。
①能说明该反应达到平衡状态的是____
a.v正(N2O4)=2v逆(NO2)
b.容器中气体的温度不变
c.容器中气体平均相对分子质量不变
d.混合气体密度不变
②达到平衡状态后,保持体积不变升高温度,再次到达平衡状态时混合气体颜色_______(填“变深”、“变浅”或“不变”), 判断理由___________。
(2)将一定量N2O4加入到恒温恒压的密闭容器中(温度298K、压强100kPa)。该反应中,正反应速率v正=k正×p(N2O4),逆反应速率v逆=k逆×p2(NO2),其中k正、k逆为速率常数,p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=_____(以k正、k逆表示)。若该条件下k正=4.4×104s-1,当N2O4分解10%时,v正=____kPa·s-1
(3)将一定量N2O4加入到恒容密闭容器中。测得不同温度下,N2O4的平衡转化率a如图所示。已知N2O4的起始压强p0为210kPa,计算图中a点对应温度下反应的压强平衡常数Kp=______。
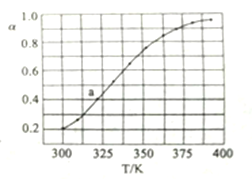
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01molL﹣1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( ) 
A.原子半径的大小W<X<Y
B.元素的非金属性Z>X>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。
|
|
|
|
|
|
|
| 0 |
第二 周期 | 3 锂 6.941 | 4 铍 9.012 | 5 硼 10.81 |
| 7 氮 14.01 | 8 氧 16.00 | 9 氟 19.00 | 10 氖 20.18 |
第三 周期 | 11 钠 22.99 |
24.31 | 13 铝 26.98 | 14 硅 28.09 |
30.97 | 16 硫 32.06 | 17 氯 35.45 | 18 氩 39.95 |
请结合上图的元素周期表回答下列问题:
(1)金属性最强的是_______,原子半径最小的是_______;(填元素符号)
(2)相对原子质量为30.97的元素属_______(填“金属”或“非金属”),位置![]() 中的元素原子核内的质子数为_______(填数值);
中的元素原子核内的质子数为_______(填数值);
(3)请画出位置![]() 中元素的离子结构示意图____________。
中元素的离子结构示意图____________。
(4)位置![]() 中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,
中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,![]() 该分子中所含化学键个数为___________。
该分子中所含化学键个数为___________。
(5)第三周期中有一种非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,请写出它溶于烧碱溶液的离子反应方程式________________。
(6)由Na、H、S、O四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(7)科学家认为存在NH5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________________________,写出NH5的电子式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com