
【题目】金刚石和石墨是碳元素的两种同素异形体,在100 kPa时,1 mol石墨转化为金刚石,要吸收1.895 kJ的热量.试判断在100 kPa压强下,下列结论正确的是( )
A.石墨比金刚石稳定
B.金刚石比石墨稳定
C.1 mol石墨比1 mol金刚石的总能量高
D.石墨转化为金刚石是物理变化
科目:高中化学 来源: 题型:
【题目】将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X。
(1)写出碳酸氢钠分解产生的气体分别与过氧化钠反应的化学反应方程式:
_________________、_________________________。
(2)残余固体X的成分是____________。
A.Na2O2、NaOH B.Na2O2、Na2CO3 C.NaOH、Na2CO3 D.Na2O2、NaOH、Na2CO3
(3)向固体X中逐滴加入1mol/L的稀盐酸至不再产生气泡为止,产生的气体在标准状况下的体积为____L。请以V(HCl)为横坐标,V(CO2)为纵坐标,画出产生CO2的体积和加入稀盐酸溶液体积的关系。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. NaNO2溶液中加入酸性KMnO4溶液:2MnO4﹣+5NO2﹣+6H+═2Mn2++5NO3﹣+3H2O
B. 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3﹣+2OH﹣═CO32﹣+NH3H2O+H2O
C. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I﹣═2Fe2++I2
D. 用惰性电极电解熔融氯化钠:2Cl﹣+2H2O═Cl2↑+H2↑+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。
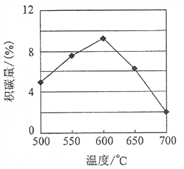
A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
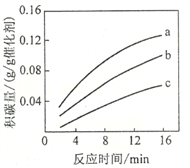
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种短周期元素,原子序数逐渐增大。请根据以下信息,用元素符号回答下列问题:
L | 原子中只有一个电子 |
M | 原子的最外层电子数是次外层电子数的2倍 |
N | 地壳中含量最多的元素 |
Q | 所在的周期数是族序数的3倍 |
R | R2+具有与氖原子相同的电子层结构 |
T | 最高正化合价与最低负化合价的代数和为6 |
(1)写出这两种元素的名称:M_________、Q________。
(2)T在周期表中的位置是______,T的原子结构示意图为_______,T的最高价氧化物对应水化物的化学式为_______。
(3)上述六种元素中原子半径最大的是__________,非金属性最强的是____________。
(4)写出MN2的电子式_________,用电子式表示化合物RT2的形成过程:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】均由两种短周期元素组成的A、B、C三种化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4。A和C分子中,其原子个数比都为1:1,B分子中原子个数比为1:2。由两种短周期元素组成的双核D离子中含有10个电子,它与A、B分子均能反应,生成一种常见的10电子分子E。请回答下列问题:
(1)C的化学式为_____。A的还原性______B的还原性(填“大于”或“小于”)
(2)写出B与D在溶液中反应的离子方程式__________。
(3)气态的A分子遇到某10电子分子会产生白烟,请写出该白烟成分的电子式_______;该白烟的水溶液与浓的含D离子的溶液在受热条件下反应的离子方程式为_________。
(4)写出一个含有18电子的五原子分子的化学式_______,其中的一种元素形成的单质可被含D离子的溶液腐蚀,发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,氯离子浓度最大的是( )
A.1L 1mol/L NaCl溶液B.2L 1mol/L KCl溶液
C.3L 1mol/L AlCl3溶液D.1L 2mol/L NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法正确的是
A. 1molCO2与SO3的混合气体氧原子数为2NA
B. 1mol/L KClO3溶液中含有NA个ClO3﹣
C. 标准状况下,11.2LCCl4所含的分子数为0.5NA
D. 25℃,1.01×105Pa,88gCO2中所含原子数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com