
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为____________。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 。增加压强,NO的转化率________________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐___________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率___________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)不同温度下,NaClO2溶液脱硫、脱硝反应中,SO2和NO的平衡分压Pe如图所示。
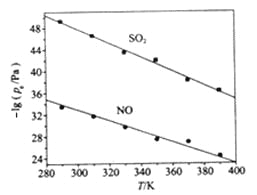
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH(aq)===SO32(aq)+H2O(l) ΔH1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq) ΔH2
CaSO4(s)===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)的ΔH= _。
【答案】(1)亚氯酸钠;
(2)①4OH-+3ClO2-+4NO===4NO3-+3Cl-+2H2O;提高;②减小;③大于;NO溶解度较低或脱硝反应活化能较高或SO2的溶解度大于NO
(3)①减小;②![]()
(4)①形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高;②△H1+△H2-△H3
【解析】试题分析:(1)NaClO2的化学名称为亚氯酸钠。
(2)①亚氯酸钠具有氧化性,分析题给数据知NaClO2溶液脱硝过程中主要生产硝酸根和氯离子,利用化合价升降法结合原子守恒和电荷守恒配平,该反应的离子方程式为2OH-+3ClO2-+4NO==4NO3-+3Cl-+2H2O;该反应正反应是气体体积减小的,则增加压强,平衡正向移动,NO的转化率提高。②根据反应的方程式2H2O+ClO2-+2SO2==2SO42-+Cl-+4H+、2H2O+3ClO2-+4NO==4NO3-+3Cl-+4H+可知随着吸收反应的进行氢离子浓度增大,吸收剂溶液的pH逐渐减小。③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高或SO2的溶解度大于NO或二氧化硫的还原性强,易被氧化。
(3)①由图像知,随着温度的升高,O2和NO的平衡分压的负对数逐渐减小,O2和NO的平衡分压逐渐增大,平衡逆向移动,脱硫、脱硝反应的平衡常数均减小。②根据反应ClO2+2SO32===2SO42+Cl写出反应的平衡常数K表达式为![]() 。
。
(4)①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是由于生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行,SO2转化率提高;②已知:a.SO2(g)+2OH(aq) ===SO32(aq)+H2O(l) ΔH1;b.ClO(aq)+SO32(aq) ===SO42(aq)+Cl(aq) ΔH2;c.CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3,根据盖斯定律知a+b-c得反应SO2(g)+ Ca2+(aq)+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)的ΔH=△H1+△H2-△H3。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】已知:2A(g)+3B(g)![]() 2C(g)+zD(g),现将2mol A与3mol B混合于2 L的恒容密闭容器中,若反应进行2 s,A的转化率为40%,测得v(D)=0.2 mol·L-1·S-1,下列有关该反应的说法错误的是( )
2C(g)+zD(g),现将2mol A与3mol B混合于2 L的恒容密闭容器中,若反应进行2 s,A的转化率为40%,测得v(D)=0.2 mol·L-1·S-1,下列有关该反应的说法错误的是( )
A.z=2
B.2s末,反应物B的浓度为0.9mol·L-1
C.若反应再经2s达平衡,则平衡时生成物D的浓度为0.8mol·L-1
D.反应达平衡时,反应物A、B的分子数之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】15分)下图所示为一个有机合成反应的流程图:
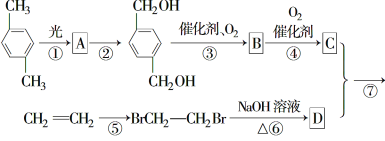

(1)、写出中间产物A、B的结构简式。
A________________, B________________,
(2)、在图中①至⑦的反应中属于取代反应的是________。(填序号)
(3)、写出下列方程式
④ :
⑥:
⑦:
(4)、写出C的同分异构体X,要求符合以下两个条件:
ⅰ.苯环上有两个侧链;
ⅱ.1 mol X与足量NaHCO3溶液反应产生1 mol CO2气体。
写出符合上述两条件的X的所有结构简式____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料﹣纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4
+NH4HSO4
(苯乙腈)
![]() +Cu(OH)2→(
+Cu(OH)2→(![]() )2Cu+H2O
)2Cu+H2O
制备苯乙酸的装置示意图如图(加热和夹持装置等略):
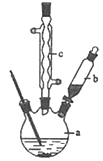
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇.
回答下列问题:
(1)在250mL三口瓶a中加入70mL 70%硫酸.配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 .
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应.在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 .反应结束后加适量冷水,再分离出苯乙酸粗品.加入冷水的目的是 ,下列仪器中可用于分离苯乙酸粗品的是 (填标号)
A、分液漏斗
B、漏斗
C、烧杯
D、直形冷凝管
E、玻璃棒
(3)提纯苯乙酸的方法是重结晶,最终得到44g纯品,则苯乙酸的产率是 .(百分数)
(4)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种香料,可采用油脂与芳香烃为主要原料,按下列路线合成:
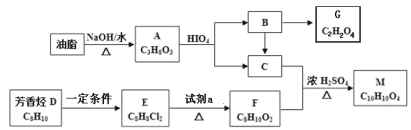
已知:① E分子的核磁共振氢谱中只有两组吸收峰;
② 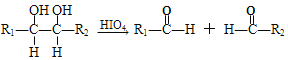 ,
,
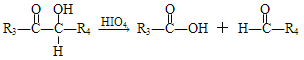
(R1、R2、R3与R4可能是氢、烃基或其他基团);
③ 1molG与足量NaHCO3溶液反应生成2molCO2气体。
(1)油脂→A的反应类型为 ,B→G的反应类型为 。
(2)D→E的化学方程式为(注明具体反应条件) 。
(3)E→F所需试剂a是 ,F的名称是 。
(4)1mol M与足量NaOH溶液反应最多消耗NaOH的物质的量为 。
(5)写出F和G发生聚合反应生成聚酯的化学方程式 。
(6)任选无机试剂,写出从Br-CH2CH2-Br→HCOOCH2CH2OOCH的合成路线 。
(合成路线常用的表示方式为:A![]() B
B![]() ……目标产物)
……目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下:2NO(g) ![]() N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)
N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)/ c(NO)
B.常温下,NO、H2O、CO2三种化合物分解放出O2的进行程度由大到小的顺序为NO>H2O>CO2
C.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定100mL浓度均为0.1mol·L-1的三种酸(HM、HN和HR)溶液,滴定的曲线如图所示,下列判断错误的是
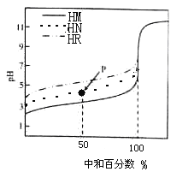
A.三种酸的电离常数关系:KHM>KHN>KHR
B.pH=7时,三种溶液中:c(M-)>c(N-)>c(R-)
C.滴定至P点时,溶液中:c(Na+)> c(N-)>c(HN)>c(H+)>c(OH-)
D.当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥剂
C.六水合氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com